細胞外からの刺激に応じて骨格の伸長や働きを変化させる微小管
東京大学は9月4日、同大医学系研究科の廣川信隆特任教授と小川覚之特任助教らの研究グループが、神経細胞における微小管脱重合の制御機構を明らかにしたと発表した。同研究成果は英科学雑誌「Cell Reports」に掲載されている。
画像はリリースより
細胞骨格のひとつである微小管は、環境や発生段階の変化、細胞外からの刺激に応じて骨格の伸長や働きを変化させる。キネシンモーター蛋白・KIF2が微小管を脱重合する働きを持ち、脳の神経回路網の形成に基本的役割を持つことはこれまでに知られていたが、その活性がどのように外界の刺激に応答して制御されているのかは明らかにされていなかった。
そこで研究グループは、神経細胞が外界の刺激に応答した際に、KIF2がどのようなシグナルネットワークによってコントロールされているのか調べるため、細胞生物学・分子生物学・生化学などの手法を融合し、質量分析法によって要となる現象を詳細かつ定量的に解析を行ったという。
神経変性疾患の発症機序の解明、治療薬開発にも期待
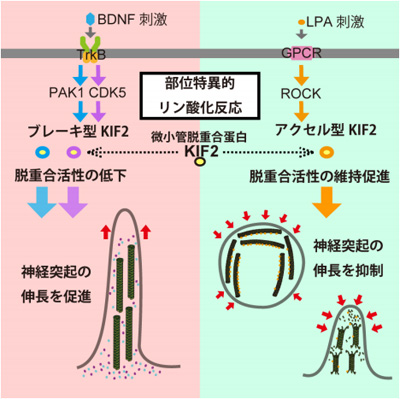
その結果、特異的なキナーゼが、微小管を脱重合する蛋白質・KIF2の特異的な部位をリン酸化し、アクセルとブレーキのように働くことによって微小管の重合・脱重合、つまり微小管の伸び縮みを制御していることを解明。なかでもPAK1やCDK5というキナーゼは、それぞれKIF2の特異的な部位をリン酸化し、KIF2の微小管脱重合活性は細胞内でも試験管内でも著しく低下したという。
一方でROCKというキナーゼは、KIF2の別の部位をリン酸化するが、KIF2の脱重合活性は維持促進。PAK1やCDK5キナーゼによりリン酸化されないようにしたKIF2変異体は脱、重合活性にブレーキがかからず、細胞内で強い脱重合活性を維持し、人為的に神経細胞の突起を伸長させる刺激(BDNF刺激)にとっても突起の伸長が減少したという。
また、PAK1やCDK5によりリン酸化されたKIF2は、ATPを加水分解する活性も著しく失っており、微小管の構成要素であるチューブリンとの結合能も低下した。これにより、PAK1/CDK5は、リン酸化によってKIF2の基本的性質を変化させ、KIF2の微小管脱重合活性を抑制することにより、神経細胞の突起伸長を促進していると考えられる。さらにROCKキナーゼによりリン酸化された形を模倣したKIF2変異体は、脱重合活性が常に維持され、丸い神経細胞から突起伸長の開始を促進する薬剤(ROCK阻害剤)を添加しても突起伸長が抑制された。
これらの結果からPAK1やCDK5はそれぞれ KIF2の特異的な部位をリン酸化することにより微小管脱重合活性を抑制する「ブレーキ」の働きをし、一方でROCKキナーゼはKIF2の別の部位をリン酸化することにより脱重合活性を維持促進する「アクセル」として働くことが分かったとしている。
今回の研究により、神経細胞は置かれた状況や外界からの刺激に応じて微小管の伸び縮みを自在にコントロールして適応していることが解明された。また、脳の神経回路網形成の基本的メカニズムが明らになったことで、今後、神経変性疾患の発症機序の解明や治療薬の開発に役立つと期待されている。
▼関連リンク
・東京大学 プレスリリース






