細胞内のあらゆる遺伝子を制御できる核酸医薬
東京医科歯科大学は8月6日、同大学院医歯学総合研究科・脳神経病態学分野の横田隆徳教授の研究グループが、大阪大学などとの共同研究により、新規の核酸医薬であるヘテロ2本鎖核酸(HDO)の開発に成功したと発表した。この研究成果の一部は、国際化学誌「Nature Communications」オンライン版8月10日付けで掲載されている。
画像はリリースより
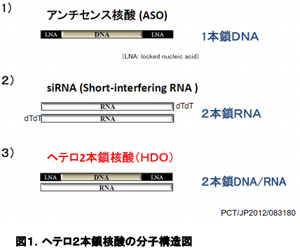
アンチセンス核酸、siRNAなどの核酸医薬を用いた遺伝子治療は、細胞膜上の分子しか標的にできない抗体医薬と異なり、細胞内のあらゆる遺伝子を制御できる。その汎用性の高さから、今まで治療困難とされてきたさまざまな疾患、特にがんや神経疾患への臨床応用が強く期待されており、核酸医薬は2013年に高脂血症薬「ミポメルセン」が米国で認可されて以来、欧米で急速に臨床応用が進展している。
その一方、生体内での有効性は未だ不十分で、特に肝臓以外の臓器へのデリバリーが困難であることが最大の問題点となっている。さらに、アンチセンス核酸やsiRNAは、その基本特許を欧米に抑えられているため、日本がこの新領域をリードするためには、有効性が高く、肝臓以外の早期へのデリバリーが可能な新規核酸の基盤技術の開発とその知財が必要だった。
日本初の分子標的核酸医薬の基盤技術として期待
今回、研究グループは、既存のアンチセンス核酸、siRNAと異なる新しい分子構造・作用機序と高い有効性を有する第3の核酸医薬「ヘテロ2本鎖核酸」の開発に成功。ヘテロ2本鎖核酸はDNA鎖を主鎖として、主鎖に相補的なRNAからなる2本鎖の人工機能核酸。RNA鎖の末端のリガンドには脂質、抗体、ペプチド、糖鎖などさまざまな細胞内外の薬剤送達システムを制御、向上させる分子を結合することが可能となった。
また、同研究グループの特許であるビタミンE(VE)をリガンド分子として相補鎖RNAに結合させ、静脈投与したところ、低投与量(0.75mg/kg)でも90-99%以上という今までにない劇的な抑制率を達成。その標的遺伝子抑制効果は、従来のアンチセンス核酸や、VE結合siRNA(VE-siRNA)と比べて飛躍的に高く、現状の核酸医薬で最高水準となったという。
さらに、既存のアンチセンス核酸の有効性を10~1000倍に増強する効果を認め、高い汎用性と大幅なコスト削減、副作用の軽減にも成功。核酸医薬の臨床応用に最大問題点であった全身投与による肝臓以外の臓器の遺伝子制御を初めて可能した。
今回の研究成果によって、従来困難だった肝臓以外での臓器の遺伝子制御が可能となり、核酸医薬の臨床応用の可能性が大きく広がった。ヘテロ2本鎖核酸は、日本発の分子標的治療の画期的な基盤技術となることが期待される。
▼関連リンク
・東京医科歯科大学 プレスリリース




