ナイーブTリンパ球のストレスの解消には、Kdelr1-PP1経路が重要
北海道大学は6月22日、同大学遺伝子病制御研究所分子神経免疫学分野の村上正晃教授らの研究グループが、Tリンパ球の存在数に異常をもつ変異マウス(T-Redマウス)を同定し、Tリンパ球がストレスを解消する機構を解明したと発表した。この研究成果は、「Nature Communications」に6月17日付けで掲載されている。
画像はリリースより
正常な免疫系には、感染症やがんを防ぐ働きがある一方、免疫系が過剰に働くとアレルギーや自己免疫疾患発症の原因にもなる。免疫系の細胞の中で中心的な役割を担うTリンパ球は、体内で一定の数を保ち、血中を循環してさまざまな異物(抗原)に対する免疫監視を行う。
まだ抗原に出会っていないTリンパ球は「ナイーブTリンパ球」、その後に抗原に遭遇し活性化したTリンパ球は「活性化Tリンパ球」と呼ばれ、その後、一部生き残ったものは「記憶Tリンパ球」と呼ばれる。ワクチン接種によって感染症を防ぐことができるのは、迅速に免疫応答を誘導することができるこの記憶Tリンパ球のおかげだ。そのため、生体内でこれらTリンパ球の生存がどのように維持されているかを解明することは、免疫系を正常に保ち、病気を防ぐことに繋がるとされる。
Tリンパ球の機能を人為的に制御する方法の開発に寄与
研究グループは、Tリンパ球の生体内での恒常性について新たな知見を得るため、変異誘導化合物ENUを用いてマウスの遺伝子に変異を導入し、その後に生まれてきたさまざまなマウスをスクリーニングした。その結果、ナイーブTリンパ球の存在数が激減した変異マウス(T-Redマウス)を同定。このマウスでは、関節リウマチモデル、多発性硬化症モデル、感染、移植等のさまざまなTリンパ球依存性の免疫応答が障害されていたという。
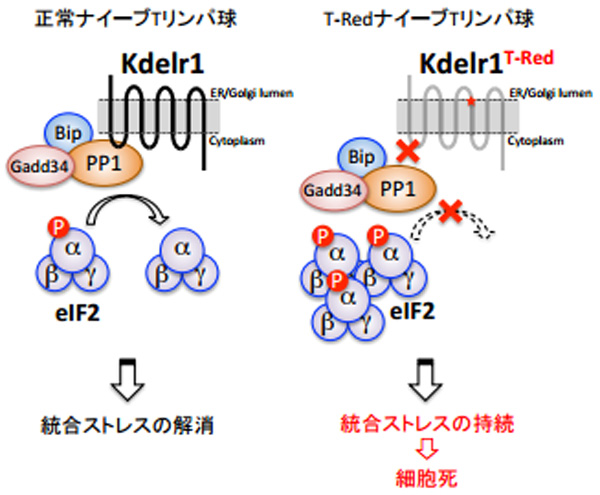
また、遺伝学的な連鎖解析によって、T-Redマウスの責任遺伝子が、小胞体/ゴルジ体間で物質輸送に関与することで知られるKdelr1遺伝子の機能欠損型点変異であることがわった。
さらに、T-RedマウスのナイーブTリンパ球が減少する原因として、変異ナイーブTリンパ球では統合ストレスが解消されないことで細胞死が誘導されることを解明。変異ナイーブTリンパ球では、変異Kderl1が脱リン酸化酵素PP1と結合ができなくなり、PP1の活性が低下し、統合ストレスを解除する因子eIF2αのリン酸化を解消できず、不必要に持続する。その結果、変異ナイーブTリンパ球ではストレス過剰状態となり、細胞死が誘導されることが明らかになったという。
今回の知見は、Tリンパ球の機能を人為的に正常に保つ方法の開発に繋がる可能性がある、と研究グループは述べている。
▼外部リンク
・北海道大学 プレスリリース




