九州がんセンター、東京医科歯科大学らの研究班が実施
九州大学は6月19日、成人T細胞白血病(ATL)に対する医師主導の治験「病因ウイルス特異抗原を標的とした成人T細胞白血病既治療例への新規複合的ワクチン療法:抗CCR4抗体を併用した自家樹状細胞療法」を同大学病院で開始したと発表した。
画像はリリースより
同治験製剤「ATL-DC-101」は、九州大学先端医療イノベーションセンターの細胞調製センター(CPC)が、九州がんセンターから委託を受けて製造したもの。この医師主導治験ならびに付随する研究は、「厚生労働科学研究費補助金がん対策推進総合研究事業」 の助成を得て、九州がんセンター、東京医科歯科大学、九州大学などで構成される研究班で行われる。
国内初の自家細胞加工製品として保険承認を目指す
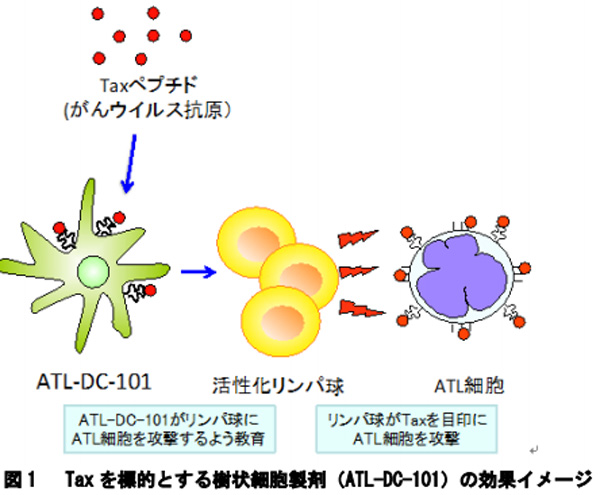
ATLは、成人T細胞白血病ウイルス1型(HTLV-1)を病因とするきわめて難治性の血液がん。研究グループは、長年このHTLV-1のTax抗原を標的とする樹状細胞ワクチン療法の開発に取り組んできており、これまでの臨床試験の結果から、ATLに対して長期にわたる効果が示唆されていた。また、現在、iPS細胞をはじめとする再生医療等製品の実用化へ向け、国による体制や制度の整備が急速に進んでおり、細胞の働きを疾病治療に応用し薬剤的に利用する「細胞製剤」も、医薬品として安全性と有効性を客観的に評価することが求められている。
今回の治験では、既に治療を受けているATL患者を被験者とし、ATL-DC-101単独または抗CCR4抗体との併用の安全性を主に評価する。患者本人の血液から作製した自家樹状細胞に、ATLの原因ウイルスであるHTLV-1のTax蛋白由来ペプチドを添加して治験薬を作り、これを皮下投与することによりATL細胞に対する免疫が活性化されることが期待されるという。この治験は、まず九州大学病院と九州がんセンターで開始され、段階的に東京医科歯科大学、名古屋市立大学でも実施される予定だ。
同研究グループは、今回の治験の結果、ATL-DC-101の安全性が確認されれば、次は再生医療等製品の実用化に対応した承認制度による初めての自家細胞製剤としての保険承認を目指したい考え。保険承認により患者の医療費負担を軽減することができ、多くのATL患者の治療に用いられることが期待される。
▼外部リンク
・九州大学 プレスリリース




