HORMAドメイン構造により、HORMA-HORMAの複合体を形成
微生物科学研究所は6月2日、高等生物のオートファジーにおける固有の因子であるAtg101の立体構造をAtg13との複合体状態でX線結晶構解析法により明らかにし、さらに立体構造情報に基づいて、Atg101がオートファジーにおいて担う機能を世界で初めて解明したと発表した。
画像はリリースより
この研究成果は、同研究所主席研究員の鈴木浩典博士研究員と、東京大学大学院医学系研究科の水島昇教授、貝塚剛志特任研究員のグループによるもの。研究成果は「NatureStructural&MolecularBiology」に6月1日付で掲載されている。
研究グループは、出芽酵母よりも進化上哺乳類に近く、Atg101を保存している分裂酵母に着目。分裂酵母由来のAtg101とAtg13の複合体を、大腸菌を用いて大量に調製し、結晶化を行った。結晶からの回折像の測定には、大型放射光施設「SPring-8 BL41XU」の強力なX線を使用し、3.0A分解能での構造決定に成功したという。
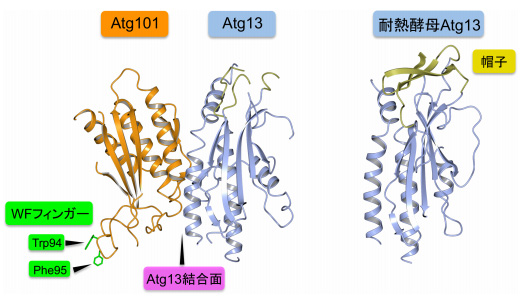
構造解析の結果、Atg101はHORMAドメイン構造を取り、Atg13もHORMAドメイン構造を取ることで、HORMA-HORMAの複合体を形成していることが明らかになった。また、出芽酵母の近縁種由来のAtg13ではタンパク質の一部が“帽子”のような構造をとり、帽子がHORMAドメイン構造に被さることで分子全体が固まった構造をとる(=安定)のに対し、分裂酵母由来のAtg13では帽子のような構造を持たず、分子全体が不安定な状態であることもわかったという。
オートファジーの始動機構の全容解明や制御剤開発へも期待
さらに、Atg101のAtg13結合面と反対の面には、他のHORMAドメインタンパク質には見られない、特徴的なループ構造が存在。このループ領域には、トリプトファン、およびフェニルアラニンという疎水性の強いアミノ酸残基が外側に突き出て存在しており、これらのアミノ酸はすべての生物種のAtg101 に保存されており、同グループは「WFフィンガー」と命名した。
哺乳類細胞を用いてヒトAtg101の機能を解析したところ、Atg101がオートファジーに働くためにはWFフィンガーが必須であり、WFフィンガーを用いて他のAtg因子群の集積に重要な役割を果たすことが判明。ULK複合体の構成因子であるAtg101は、他のAtg因子群をオートファジー進行の場へと連れてくることで、オートファジーの始動を引き起こすことが明らかとなった。
今回の結果を受けて、オートファジーの始動機構の全容解明に向けた研究の加速が見込まれる。また、オートファジーの始動機構が明らかになることで、今後オートファジーを特異的に制御する薬剤開発に繋がることが期待できるとしている。
▼外部リンク
・微生物科学研究所 プレスリリース




