Regnase-1とRoquinが炎症のブレーキとして機能
京都大学は5月22日、同大学ウイルス研究所の三野享史助教、竹内理教授らの研究グループが、ドイツのマックス・デルブリュック分子医学センター(MDC)、近畿大学、大阪大学、東京大学、オーストラリア国立大学と共同で、病原体感染などに対する炎症反応が、RNA分解酵素「Regnase-1」とRNA結合蛋白質「Roquin」という、不必要なmRNAを分解する2つのブレーキシステムにより巧妙に制御されていることを解明したと発表した。この研究成果は、米科学誌「Cell」誌に5月21日付で掲載されている。
画像はリリースより
病原体感染に対する炎症反応は、マクロファージなどの自然免疫担当細胞が炎症性サイトカインを分泌することにより引き起こされる。炎症の活性化と抑制はバランス良く調節されているが、このバランスの破綻が、免疫不全症や、自己免疫疾患を始めとした炎症性疾患の原因となると考えられている。
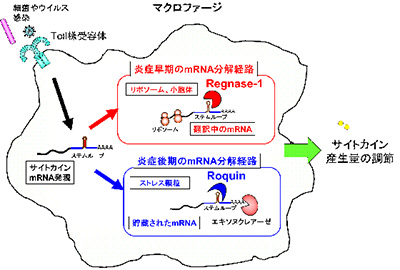
また、マクロファージから分泌される炎症性サイトカインの量は、mRNA産生と分解により厳密に制御されていることが知られている。これまで、Regnase-1、Roquinという蛋白質がmRNAに結合し分解すること、これらの分子をマウスで欠損させると自己免疫疾患を発症することが分かっていたが、その詳細な機構は不明だった。
機能する空間/場、時期、メカニズムがそれぞれ異なることを解明
今回の研究で、2つの異なるRNA結合蛋白質Regnase-1とRoquinが、炎症性サイトカインmRNAに存在する同じステムループ構造を認識し、分解することで炎症性サイトカイン量を制御していることが判明。さらに、それら2つは同じRNA構造を認識しつつも、機能する空間/場、分解するmRNAの翻訳状態や分解のメカニズムが異なること、分解する時期も、それぞれ炎症早期、後期と異なることを解明したという。
研究グループは今後、ヒト自己免疫疾患や炎症性疾患におけるRegnase-1、Roquinの機能を検討することで、これらの疾患の病態解明につなげていきたいと述べている。また、Regnase-1、Roquinの機能を変化させることは、自己免疫疾患や炎症性疾患などの創薬ターゲットとなることが期待できるとしている。
▼外部リンク
・京都大学 研究成果




