神経回路形成のメカニズム解明や神経発達障害の研究に役立つ知見
科学技術振興機構(JST)は4月24日、東京大学放射光連携研究機構の深井周也准教授らの研究グループが、自閉症などの神経発達障害に関連するタンパク質同士が結合した状態の立体構造を決定し、神経細胞同士を適切につなぐ仕組みを解明したと発表した。
画像はリリースより
神経細胞間のシナプスの形成と再編は、神経回路の形成や記憶学習の際に起きる極めて重要なステップであり、その調節機構の破綻はさまざまな神経発達障害の発症と密接に関連することが示唆されている。自閉症などの神経発達障害に関連するタンパク質であるPTPδとIL1RAPL1/IL-1RAcPは、それぞれ軸索末端と樹状突起に発現し、選択的に相互作用することで神経伝達物質の放出を行うシナプス前終末と神経伝達物質の受容を行うシナプス後終末への分化誘導を促す。
富山大学の吉田知之准教授らは、この選択的相互作用がPTPδのスプライシングで挿入される短いペプチド(ミニエクソンペプチド)により調節されることを見出し、ミニエクソンペプチドがシナプス標的認識の暗号として機能することを提唱してきたが、その仕組みの詳細は不明だった。
SPring-8、X線結晶構造解析でPTPδ‐IL1RAPL1などの立体構造を決定
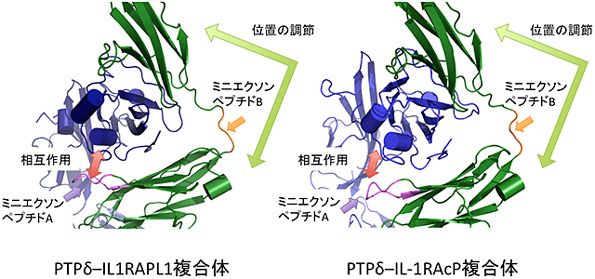
研究グループはPTPδ-IL1RAPL1及びPTPδ‐IL-1RAcP複合体の立体構造からPTPδのミニエクソンペプチドA及びB配列のもつシナプス標的識別暗号を解読するメカニズムを明らかにすることを試みた。それぞれの複合体の結晶を作成し、兵庫県の大型放射光施設SPring-8、及び茨城県のPF(フォトンファクトリー)の高輝度X線を利用したX線結晶構造解析により、PTPδ‐IL1RAPL1及びPTPδ‐IL-1RAcP複合体の立体構造を決定した。
その結果、ミニエクソンペプチドAは、IL1RAPL1及びIL-1RAcPとの結合面を構成することが明らかになった。一方、ミニエクソンペプチドBは、2つのイムノグロブリン様ドメインの間に挿入され、ドメイン間の位置関係を調節するリンカーとしてIL1RAPL1及びIL-1RAcPとの結合に寄与することが明らかになったという。
また、2つのミニエクソンペプチドはシナプスオーガナイザー複合体形成の特異性保持において異なる役割を担うことも判明。これは、シナプス標的識別暗号を解読する新規のメカニズムだ。このメカニズムの詳細を明らかにすることによって、ミニエクソンペプチドがシナプス標的認識の暗号として機能することが裏付けられたとしている。
この成果は、神経回路形成のメカニズムの解明や自閉症などの神経発達障害に関わる今後の研究に役立つ知見になると研究グループは述べている。
▼外部リンク
・科学技術振興機構 共同発表




