複合体としての立体構造を世界で初めて解明
九州大学は2月27日、同大大学院医学研究院ウイルス学分野の橋口隆生助教ら研究グループが、マールブルグウイルスとエボラウイルスの両方に結合できるヒト抗体をマールブルグ出血熱の生存者由来B細胞から特定し、ウイルスが細胞に侵入する際に必須の役割をするGP蛋白質との複合体としての立体構造を解明することに成功したと発表した。これは、米国スクリプス研究所のErica Ollmann Saphire教授、ヴァンダービルト大学のJames E. Crowe, Jr.教授らとの国際共同研究による成果である。
画像はプレスリリースより
マールブルグウイルスは、エボラウイルスとともにフィロウイルス科というグループに属し、ほぼ同様の重篤な症状と高い致死率を示す危険性の非常に高いウイルス。これら2つのウイルスが人体内の細胞に侵入する(感染する)には、ウイルス表面にあるGP蛋白質が人の細胞上の受容体と結合することが必要だ。一方でGP蛋白質は、体内の免疫応答で作られる抗体がウイルスを排除するために主に攻撃の標的とする分子でもある。
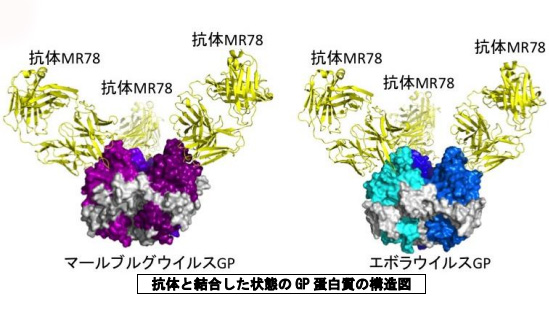
研究グループは今回、マールブルグ出血熱の感染生存者由来B細胞からスクリーニングによって抗体を複数選び出し、その中にマールブルグウイルスにもエボラウイルスにも結合する能力のある抗体(MR78)が存在することを発見したという。
抗体医薬や抗ウイルス薬、ワクチン開発につながる成果
さらに、研究グループは、抗体と結合した状態のGP蛋白質を大量に精製したのち、結晶化し、X線を用いてその構造を原子レベルで明らかにすることに成功。その結果から、抗体MR78は、エボラウイルスとマールブルグウイルスのGP蛋白質の、非常に類似したアミノ酸配列を立体的に認識して結合することがわかったという。マールブルグウイルスが抗体MR78と結合する領域は、受容体と結合する部位(感染に必須である部位)と一部重なっているため、抗体はマールブルグウイルスの感染を効果的に中和する事ができると考えられる。
さらにX線小角散乱解析から、マールブルグウイルスにもエボラウイルスにも存在するムチン様ドメインの配置が両者で異なることが、中和抗体を誘導する能力の違いに関係している可能性を示す結果を得たという。これにより、マールブルグウイルスとエボラウイルスの感染防御には、それぞれどの領域を標的にした抗体を作成することが効果的なのか、明らかになるとしている。
この研究成果で解明された、抗体と結合した状態のマールブルグウイルスのGP蛋白質の構造は国際機関のProtein Data Bank (PDB)に登録され、世界中の研究者が無料で自由に利用可能となった。これにより、マールブルグ出血熱・エボラ出血熱の根絶に向けた研究が加速すると、研究グループは期待を寄せている。
▼外部リンク
・九州大学 プレスリリース




