未解明だったマスト細胞・好塩基球の活性制御
大阪大学は2月18日、喘息や、アトピーなどの皮膚アレルギーを引き起こすマスト細胞と好塩基球の活性を抑えるメカニズムを突き止めたと発表した。この研究は、同大大学院医学系研究科感染症・免疫学講座(免疫制御学)免疫学フロンティア研究センターの竹田潔教授らのグループによるもの。研究成果は、米科学誌「Immunity」オンライン版に、2月17日付けで公開されている。
この画像はイメージです
今回の研究は、科学技術振興機構(JST)の戦略的創造研究推進事業チーム型研究(CREST)の研究領域「アレルギー疾患・自己免疫疾患などの発症機構と治療技術」における研究課題「自然免疫系を標的とした腸管免疫疾患の制御技術の開発」の一環として行われた。大阪大学、東京大学、東京医科歯科大学との共同研究である。
近年、患者数が増加の一途をたどる喘息やアトピーなどのアレルギー疾患は、血液系細胞であるマスト細胞と好塩基球によって引き起こされることが知られている。しかし、マスト細胞・好塩基球の活性が普段どのように制御されているかについては未解明なままだった。
E-NPP3がATP依存性のマスト細胞・好塩基球によるアレルギー反応を抑制
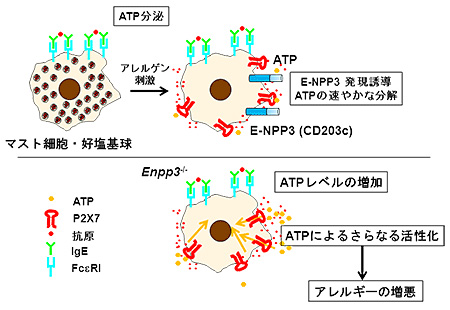
研究グループは、アレルゲンによって活性化されたマスト細胞・好塩基球で発現が高くなる酵素、E-NPP3(CD203c)に着目。このE-NPP3を欠損したマウスを作製した。その結果、マスト細胞・好塩基球が活性化状態になり、皮膚アレルギー、食物アレルギー、喘息が悪化することを見出したという。
また、E-NPP3はアデノシン三リン酸(ATP)を分解する膜型酵素であることから、血中ATP濃度を測定し、ATPのアレルギーへの関与を調査。すると、アレルゲンで活性化されたマスト細胞・好塩基球はATPを分泌し、分泌されたATPがマスト細胞・好塩基球自身をさらに活性化、アレルギーを悪化させていることが明らかになったという。
さらに、ATPはP2受容体群を介して細胞に作用するが、P2受容体のひとつであるP2X7を欠損させると、E-NPP3欠損マスト細胞・好塩基球の活性は減弱し、その数も減少したという。
今回の研究成果により、E-NPP3がATP依存性のマスト細胞・好塩基球によるアレルギー反応を抑えることを明らかになった。研究グループは今後、ATP、E-NPP3を標的としてマスト細胞・好塩基球の活性を制御することにより、アレルギーの新たな治療薬の開発に繋がることが期待できると報告している。
▼外部リンク
・科学技術振興機構 プレスリリース




