CYLDとポリユビキチン鎖が結合した立体構造を決定
東京大学と科学技術振興機構は2月17日、同大学放射光連携研究機構の深井周也准教授らの研究グループが、がん抑制タンパク質CYLDと、免疫応答の促進に関与する2種類のポリユビキチン鎖とが結合した状態の立体構造を決定し、CYLDがポリユビキチン鎖を切断する方法を解明したと発表した。
画像はプレスリリースより
ポリユビキチン鎖とは、ユビキチンと呼ばれる小さなタンパク質が細胞内でいくつもつながったもので、そのつながり方の違いによって、制御される生体反応は異なる。このつながり方は、ユビキチンが次のユビキチンとどの場所でつながるかによって異なり、8種類のつながり方がある。
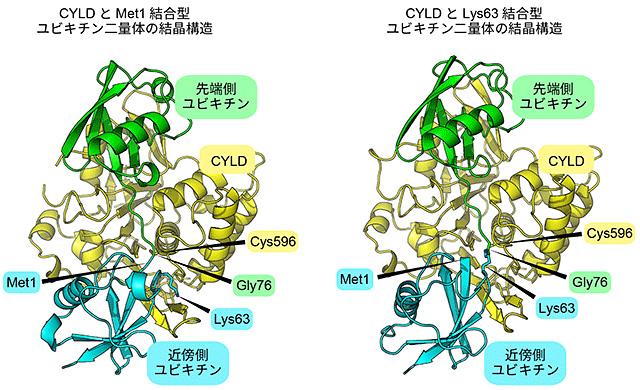
このうち、先頭のメチオニン(Met1)でユビキチン同士がつながったポリユビキチン鎖や、63番目のリジン(Lys63)でつながったポリユビキチン鎖は、CYLDにより適切に切断されなければ、過剰な免疫応答を引き起こし、腫瘍形成や細胞のがん化へと進展することが知られている。しかし、Met1と、Lys63とでつながったポリユビキチン鎖では、その構造は異なり、CYLDが双方をどのように区別して認識し、切断しているのかは不明だった。
免疫応答や炎症反応、腫瘍形成の原因解明に役立つ知見
今回、深井准教授らは、CYLDとMet1でつながったポリユビキチン鎖とが結合した状態の立体構造および、CYLDとLys63でつながったポリユビキチン鎖とが結合した状態の立体構造を決定することで、CYLDがそれぞれのポリユビキチン鎖に対応して構造を変化させて、ポリユビキチン鎖を切断していることを明らかにしたという。
今後、8種類存在するポリユビキチン鎖を生命がどのように識別しているのかを明らかにすることで、ポリユビキチン鎖の機能について理解を深めることができるとしている。また、今回の成果は、免疫応答や炎症反応、腫瘍形成、細胞のがん化を解明する今後の研究に役立つと、研究グループは述べている。
▼外部リンク
・東京大学/科学技術振興機構 プレスリリース




