炎症性腸疾患の病態解明の大きなヒントに
順天堂大学は2月13日、同大大学院医学研究科・アトピー疾患研究センターの北浦次郎先任准教授、奥村康センター長らのグループが、炎症性腸疾患を抑える生体内の仕組みを明らかにしたと発表した。この研究成果は、英科学誌「Gut」電子版に2月11日付で掲載されている。
画像はプレスリリースより
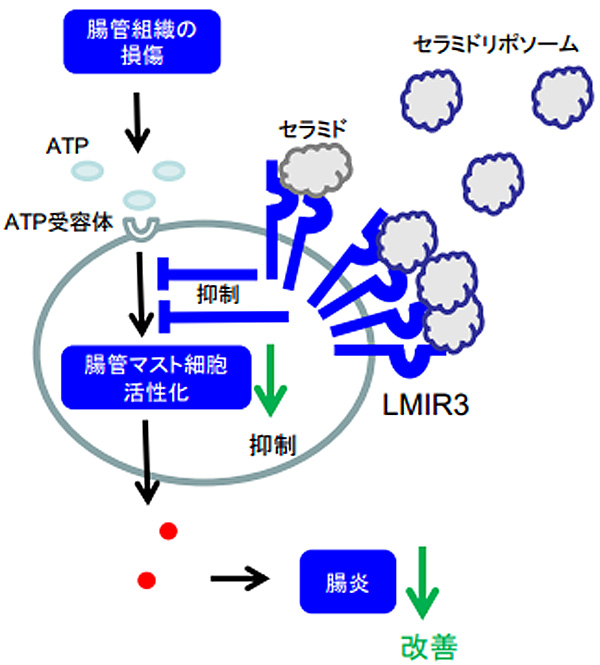
研究グループは、クローン病や潰瘍性大腸炎に代表される炎症性腸疾患の仕組みを明らかにすることに取り組み、免疫を担うマスト細胞に発現する受容体LMIR3が脂質セラミドに結合して、IgE受容体を介するアレルギー反応を抑えることを明らかにしてきた。
近年、損傷を受けた腸管組織から産生されるATPがマスト細胞を活性化して炎症性腸疾患を悪化させることが報告されていた。そこで、同研究グループは、受容体LMIR3とATPの関係に着目し、LMIR3がATP受容体を介するマスト細胞の活性化も抑制することで、炎症性腸疾患の発症・進展を抑えられるのではないかと仮説を立て、今回の研究を行ったという。
抑制型受容体LMIR3を標的とした新しい治療の可能性
研究グループは、抑制型受容体LMIR3(CD300f)の遺伝子欠損マウスの炎症性腸疾患モデルを解析。その結果、興味深いことにLMIR3を欠損したマウスでは、腸炎が著しく悪化したという。また、マスト細胞を欠損するマウスの解析などから、マスト細胞に発現するLMIR3が腸炎の悪化を抑えることが判明。加えて、in vitro実験において、ATPの刺激によるマスト細胞の活性化は、LMIR3と脂質セラミドの結合によって抑制されることも分かったとしている。
さらに、生体内におけるLMIR3と脂質セラミドの結合にも着目。野生型マウスの腸炎は、結合を阻害するセラミド抗体を投与すると悪化すること、結合を促進するセラミドリポソームを投与すると有意に改善することが判明した。なお、これらの投与は、LMIR3を欠損するマウスの病態には影響しなかったとしている。
これらの結果より、腸管マスト細胞に発現するLMIR3と脂質セラミドの結合は、ATPによるマスト細胞の活性化を抑制して、炎症性腸疾患の発症・進展を抑えることが初めて明らかになった。研究グループは今後、セラミドリポソームの予防的投与や炎症性腸疾患発症後の治療的投与がどの程度有効であるかを明らかにし、新たな予防・治療法の開発につなげたいとしている。
▼外部リンク
・順天堂大学 ニュースリリース




