不明点が多かったアミロイドβの蓄積メカニズム
理化学研究所は1月15日、バイセクト糖鎖と呼ばれる糖鎖がアルツハイマー病を進行させることを発見したと発表した。この研究は、同研究所グローバル研究クラスタ疾患糖鎖研究チームの木塚康彦基礎科学特別研究員らの共同研究グループによるもの。同研究結果は、医学専門誌「EMBO Molecular Medicine」のオンライン版に同日付けで掲載されている。
画像はプレスリリースより
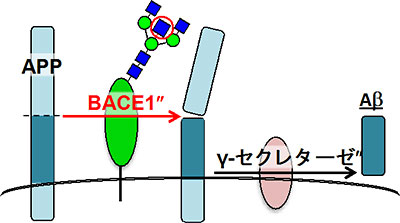
アルツハイマー病は、認知症患者の60%以上を占める疾患だが、現状では有効な治療薬・予防薬が少ないため、その開発が強く望まれている。アルツハイマー病の原因として現在最も有力な「アミロイドカスケード仮説」では、アミロイドβ(Aβ)と呼ばれるペプチドが脳に蓄積することが発症の引き金となり、最終的に神経細胞の死や脳の萎縮へつながると考えられている。しかし、このAβが蓄積していくメカニズムについては、未解明な点が多く残されていた。
より副作用の少ない新規のアルツハイマー病治療薬を検索
今回研究グループは、糖が鎖状につながった糖鎖と呼ばれるタンパク質の修飾に着目。なかでも、脳に豊富に存在するバイセクト糖鎖に注目した。バイセクト糖鎖については近年、アルツハイマー病患者の脳でその量が増えているという研究結果が報告されている。そのため、バイセクト糖鎖がアルツハイマー病の発症や進行にどのように関わるのかについて調査した。
まず、研究グループは、バイセクト糖鎖を作る酵素「GnT-III」を欠損させたマウスを用い、脳内のAβの蓄積を調査。その結果、バイセクト糖鎖を持たないマウスでは、Aβの蓄積が激減し、認知・記憶能力の低下を防げることが示されたという。
また、AβはBACE1(βセクレターゼ)と呼ばれる酵素によって作られることが知られているが、同研究グループは、BACE1がバイセクト糖鎖を持っていること、また、バイセクト糖鎖を欠損させるとBACE1がAβの前駆体タンパク質(APP)と細胞内で異なる分布を示すようになり、その結果Aβの産生を抑制できることを突き止めた。
これらの結果から、バイセクト糖鎖を作る酵素GnT-IIIの阻害剤は新規のアルツハイマー病治療薬となる可能性が示唆された。現状でも、BACE1の阻害剤は有望な治療薬候補として期待され、実際にいくつかのBACE1阻害剤が臨床試験に入っている。しかし、BACE1はAPP以外にも多様なタンパク質の切断を行っているため、阻害剤が副作用を持つ可能性が懸念されている。
BACE1に結合するバイセクト糖鎖を標的にした場合、より副作用の少ない阻害剤となる可能性があるという。同研究グループは現在、理研創薬・医療技術基盤プログラムの協力のもと、GnT-IIIの阻害効果を持つ化合物を探索する研究を進めている。
▼外部リンク
・理化学研究所 プレスリリース




