IL-18複合体を原子の解像度で構造解明
京都大学は12月16日、インターロイキン18(IL-18)が受容体(レセプター)に結合した複合体の立体構造を解明したと発表した。
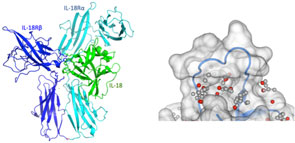
画像はプレスリリースより
この研究は、同大理学研究科の杤尾豪人教授、工学研究科の白川昌宏教授らの研究グループと、岐阜大学医学系研究科小児病態学、同連合創薬医療情報研究科などが共同で行ったもの。この成果は「Nature Communications」に12月15日付で公開されている。
サイトカインのひとつであるIL-18は、体内に侵入してきた病原体を排除するように働く有益な分子であり、炎症を強く誘導し、病原体の排除に働く一方で、何らかの理由で過剰に産生されると関節リウマチなど免疫・神経難病を含む、多くの疾患の発症・増悪が引き起こされる。このインターロイキン活性化に対する薬剤としては、抗体をはじめとする生物製剤が臨床応用されているが、細胞膜の中や核にまで入り込むことができる、低分子薬剤の開発は十分でなかった。IL-18についても阻害薬剤開発が期待されていたが、研究の開始から約20年の間、未解明だったという。
IL-18はIL-18レセプターαに囲まれるように結合
同研究グループは、遺伝子組み換え技術を用い、IL-18蛋白とIL-18レセプター蛋白を合成。エックス線結晶構造解析の技術により、複合体の立体構造を原子解像度で明らかにした。これによりIL-18はIL-18レセプターαに囲まれるように結合し、IL-18レセプターβはIL-18レセプターαの側面に並んでIL-18と結合することが判明したという。
また、IL-18とIL-18レセプターβの相互作用面に位置するアミノ酸の作用を溶液NMR法や表面プラズモン解析、細胞機能実験の手法を用いて測定。IL-18側とIL-18レセプターβ側に位置するそれぞれ数個のアミノ酸が、相互作用に重要な働きを持つことが分かったとしている。
これらの結果は、これまで未解明なままであったIL-18のシグナル伝達の詳細を世界で初めて明らかにしたもので、過剰なIL-18の働きを抑制することで、関連疾患を治療する薬剤開発の進展が期待される。(遠藤るりこ)
▼外部リンク
・京都大学 研究成果




