脂質分解酵素ファミリーの生理的役割研究から発見
東京都医学総合研究所は6月6日、ホスホリパーゼA2(PLA2)分子ファミリーの研究を通じ、肥満の新調節機構を解明したと発表した。
画像はプレスリリースより
脂肪細胞から分泌される2種の脂質分解酵素が、それぞれ肥満を改善または促進させていたという。この研究成果は6月5日付で「Cell Metabolism」オンライン版に掲載されている。
PLA2G5は肥満を改善、PLA2G2Eは肥満を促進
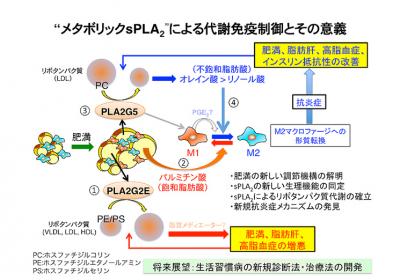
研究グループはまず、肥満マウスと通常マウスで脂肪組織の遺伝子発現をマイクロアレイで比較。PLA2G5とPLA2G2Eが肥満マウス脂肪細胞で著しく発現誘導されていたため、この各遺伝子欠損マウスでメタボリックシンドロームの表現型解析を行った。
PLA2G5欠損マウスでは、高脂肪食を与えると野生型に比べ肥満が増悪、内臓脂肪蓄積、脂肪肝、高脂血症、インスリン抵抗性も増悪した。欠損マウス内臓脂肪組織では、炎症促進性マクロファージが増加し、炎症抑制性マクロファージは減少、慢性炎症が促進されていたという。
リピドミクスを実施すると、PLA2G5は血漿中の低密度リポタンパク質粒子に作用し、粒子を構成するある種のリン脂質から不飽和脂肪酸を遊離していた。
肥満脂肪細胞からの大量な飽和脂肪酸は、M1マクロファージを誘導する。PLA2G5で遊離された不飽和脂肪酸はこの誘導に拮抗的に作用し、M2マクロファージへの形質変換を促進、慢性炎症を抑制していた。このことはヒト内臓脂肪組織でも確認されているという。
PPLA2G2E欠損マウスでは、高脂肪食を与えても野生型より肥満や脂肪肝、高脂血症になりにくかった。リピドミクス解析を行うと、PLA2G2Eはリポタンパク質中の別種のリン脂質を選択的に分解していたという。
よってPLA2G2Eは、リポタンパク質の微量リン脂質量を調節、脂肪組織や肝臓への脂質の運搬・貯蔵を担うとみられる。また多様なリン脂質の質・量変動が全身の代謝に影響を及ぼすことも示された。
肥満マーカーやメタボリックシンドロームの予防・治療法開発に
今回の研究は、脂肪細胞から分泌され肥満を調節する分泌性PLA2を初めて同定した。またPLA2G5は定説と異なり、リポタンパク質から不飽和脂肪酸を動員して脂質メディエーター非依存的に代謝性慢性炎症を抑制していた。
今後、内臓脂肪組織における分泌性PLA2の発現量や不飽和脂肪酸量は、肥満の新規診断マーカーとなる可能性がある。また分泌性PLA2を標的とした創薬は、メタボリックシンドロームの新たな予防・治療法開発につながると期待される。(紫音 裕)
▼外部リンク
・公益財団法人 東京都医学総合研究所/東京都福祉保健局/科学技術振興機構 プレスリリース
・The Adipocyte-Inducible Secreted Phospholipases PLA2G5 and PLA2G2E Play Distinct Roles in Obesity




