発がん遺伝子の活性化に必須の膜たんぱく質立体構造を解明
12月2日、科学技術振興機構(JST)と京都大学は、がんを引き起こすプロセスの鍵となる膜たんぱく質Rce1(アールシーイーワン)の立体構造と働きを世界で初めて解明することに成功したと発表した。
この研究は、京都大学大学院医学研究科の岩田想教授、小笠原諭研究員(現:東北大学大学院医学系研究科助教)らのグループによって進められたもので、英国がん研究所のデビッド・バーフォード教授らとの共同研究になっている。この研究成果は、英国時間の12月1日、「Nature」オンライン速報版に掲載された。

(記事内の画像はプレスリリースより)
細胞制御に関わる重要分子Ras(ラス)たんぱく質は、常に活性化状態となるような突然変異により、高頻度でがんを引き起こす。Rasたんぱく質の活性化には、特定の部分がたんぱく質分解酵素のRce1によって切断されることが必須である。この切断が起こらない場合、Rasたんぱく質の細胞膜への移行が妨げられ、がんを引き起こす働きが抑制されることが分かっている。
英国がん研究所のバーフォード教授の研究室では、古細菌由来Rce1の大量発現・精製に成功し、結晶構造解析を試みていたという。しかし、膜たんぱく質を高純度に精製することには成功し、結晶が得られるものの、良好な結晶を生むことは難しく、詳細な立体構造を解明するには至っていなかったという。
抗体を用いる新技術で良好な結晶を得ることに成功、立体構造を原子レベルで解明
そこで、膜たんぱく質の構造解析に成功していた岩田想教授に協力を要請し、共同研究が実現したそうだ。
研究グループでは、抗体フラグメントを用いた独自技術で膜たんぱく質の結晶化を試みた。この方法では、抗体フラグメントが膜たんぱく質に結合することで、接着剤のような役割を果たし、親水性領域が拡大して規則正しく並ぶようになるため、良質な膜たんぱく質の結晶化が促進される。
この技術をさらに効率化・迅速化するため、微量の膜たんぱく質と抗体の複合体を蛍光によって検出する新たな方法を見出し、短期間にRce1たんぱく質の立体構造を認識する抗体の作製に成功、作製した抗体フラグメントを用いて、Rce1と抗体フラグメントを一緒に結晶化する条件の最適化を行い、最終的に高精度で立体構造を解析することができたという。
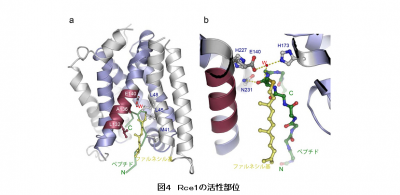
得られた立体構造の詳細情報から、Rce1の活性中心部位の形は、他のたんぱく質分解酵素と似ていることが分かり、さらにコンピューターシミュレーションを用いてRce1の基質であるRasたんぱく質をドッキングさせたところ、この抗体フラグメントは、Rce1がRasたんぱく質などの基質と結合する“くぼみ”付近に結合していても、その結合を邪魔することなく、Rce1を活性型の状態で固定化する機能をもつものであることが判明したという。
このことから、Rce1は酵素反応の活性中心部位である“くぼみ”が開くことで、Rasたんぱく質のペプチドを認識し、適切な位置で切断するものと考えられている。
発がん遺伝子の活性を抑え、がんを抑制する薬剤の開発に期待
研究グループでは、こうした構造情報が解明されたことで、Rce1の酵素活性を阻害する、もしくは調節できる薬剤の探索や設計が可能になると考えられるとしている。これにより、発がん遺伝子の活性を抑え、がんを抑制する薬剤の開発につながることが期待されている。
また、今回の研究で用いられた膜たんぱく質の立体構造を認識する新たな抗体フラグメント作製技術は、これまで立体構造解析が難しかった多くの膜たんぱく質における他の研究におおいに寄与するものとなることも見込まれる。(紫音 裕)
▼外部リンク
科学技術振興機構/京都大学 共同プレスリリース
http://www.jst.go.jp/pr/announce/20131202/index.html
Mechanism of farnesylated CAAX protein processing by the intramembrane protease Rce1
http://www.nature.com/nature/journal/vaop/ncurrent/




