熊本大学発生医学研究所が発表
代表的なAAA型分子シャペロンであり、細胞周期の調節や、小胞体関連分解、異常タンパク質の凝集抑制・分解など、さまざまな細胞過程に関与していることが判明してきているp97(ヒトをはじめ哺乳類ではVCP)。10月4日、熊本大学発生医学研究所は、このp97のATP依存的な構造変化の直接可視化に成功したと発表した。
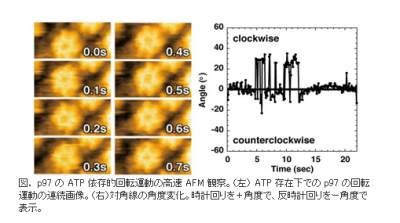
この研究成果をおさめたのは、分子細胞制御分野の野井健太郎研究員らで、金沢大学の安藤敏夫教授らが開発した、高速原子間力顕微鏡を用いて、生のp97を観察したという。
ヒトにおけるVCPの変異は、認知症や筋委縮性側索硬化症を引き起こすことなどが報告されている。これまでの研究により、ATP加水分解の過程でダイナミックな構造変化を起こすことが示唆されており、この構造変化がp97の機能に重要であると考えられてきたものの、実際にその構造変化を直接観察することは、従来の手法では困難であり、機能における構造変化の意義も未知の部分が多かった。
(画像はプレスリリースより)
疾患発症機序の解明に期待
研究グループは、高速原子間力顕微鏡を用いた観察で、p97はX線結晶解析の結果と同様に、リング状の6量体構造を形成し、ATP存在下で時計回りに約23度回転、その後またもとの位置に戻るという構造変化を繰り返していることを確認した。こうした回転は、ヌクレオチド非存在下や、ADP存在下においては観察されなかったという。
また、変異体を用いた観察によって、p97の時計回りの回転は、D2 ATPaseドメインにATPが結合して引き起こされていることも発見した。つまり、D2 ATPaseドメインにATPが結合して回転し、加水分解によって元に戻るという運動を繰り返していた。
このように、作動中の分子シャペロンのダイナミクスを直接可視化することに成功したのは初めての例であり、今後は基質タンパク質への作用についても可視化できる可能性があるという。そうした研究を通じ、p97の機能解明やその変異によって引き起こされるヒト疾患の発症機序の解明が進むと期待される。なお、この研究成果は、Structure誌オンライン版に9月20日付で掲載されている。(紫音 裕)
▼外部リンク
熊本大学発生医学研究所 プレスリリース
http://www.imeg.kumamoto-u.ac.jp/newpress/np64.html
Structure 該当研究論文
High-Speed Atomic Force Microscopic Observation of ATP-Dependent Rotation of the AAA+ Chaperone p97
http://www.sciencedirect.com/science/article/




