高血圧症治療の標的「アンジオテンシン2」
京都大学は7月23日、血圧の調節に重要なペプチドホルモンであるアンジオテンシンが結合したアンジオテンシン2受容体(ATR)の立体構造を明らかにしたと発表した。この研究は、同大大学院医学研究科の浅田秀基特定助教、岩田想教授らの研究グループによるもの。研究成果は「Nature Structural&Molecular Biology」に掲載されている。
画像はリリースより
現在、約1000万人(平成26年度:厚生労働省)が、高血圧性疾患を罹患している。その年間医療費は約1兆9000億円(平成26年度)、高血圧性疾患による死亡者数は約6,900人(平成26年度)であり、健康長寿社会の実現にとって非常に重要な疾患と考えられている。
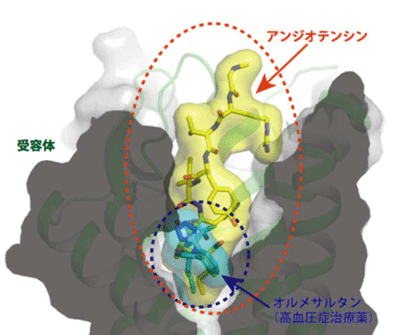
ATRは、血圧の調節において重要な役割を担うGタンパク質共役受容体(GPCR)。ATRには血圧を上げる1型受容体(AT1R)と血圧を下げる2型受容体(AT2R)の二つの受容体が存在しており、血圧は、これらの二つの受容体が協力し合うことで調節されている。この協調を制御しているのが、生理活性ペプチドであるアンジオテンシン2(Ang2)で、Ang2がどちらの受容体に結合するかによって血圧が上昇するか下降するかが決まる。Ang2は高血圧症の治療に対する標的となっており、その結合を阻害するアンジオテンシン受容体拮抗薬(ARB)が高血圧症の治療薬として広く使用されている。
既存のARBはAng2のリガンド結合部位の下部のみを利用
研究グループは、s-Ang2が結合したAT2Rの構造を、抗体フラグメントとの複合体を形成させることで結晶化に成功し、その立体構造を原子レベルで解明した。
今回の研究では、膜タンパク質の立体構造を認識する抗体作製法を利用することで、AT2Rに対する特異的な抗体を作製。この抗体は、AT2Rの構造を固定すること、結晶化を促進させること、s-Ang2がAT2Rに対して結合するのを助けるなど、特別な機能を持つこともわかった。また、得られた立体構造から、s-Ang2のC末端がAT2Rのリガンド結合部位の底に配位するように結合していることも明らかになった。さらに、s-Ang2が結合した構造とARBであるオルメサルタンが結合した構造を比較したところ、s-Ang2は受容体の広い範囲を使って結合しているのに対し、オルメサルタンは受容体のリガンド結合ポケットのほんの一部しか使っていないことが判明したという。
今回の研究結果から、既存のARBはAng2のリガンド結合部位のうち、その下部のみしか利用していないが、その中心付近や上部で結合するARBも考えられると推測され、このような視点で薬を開発することで、副作用のない新しい薬が開発される可能性がある。AT2Rは虚血性心疾患における心血管保護、脳梗塞時における脳血管保護や帯状疱疹後疼痛などにも重要な役割を担っており、構造に基づく創薬(SBDD)も可能にするものと期待できる、と研究グループは述べている。また、今後さらにATRとAng2の構造から、血圧調節機構の全体像を原子レベルで明らかにしていく考えだという。
▼関連リンク
・京都大学 研究成果



