A鎖、B鎖を水溶液中で混合するだけで目的のインスリンを獲得
東海大学は5月7日、インスリンを構成する2本の異なるポリペプチド鎖(A鎖およびB鎖)が水溶液中で自己組織化してインスリンの構造を獲得するメカニズムの全容を解明した。さらに、その知見をもとにA鎖およびB鎖を水溶液中で混合するだけで、目的のインスリンを得る簡便なインスリン合成法も開発したと発表した。この研究は、同大理学部化学科の荒井堅太講師、岩岡道夫教授、大阪大学蛋白質研究所の北條裕信教授、東北大学多元物質科学研究所の稲葉謙次教授、東北大学学際科学フロンティア研究の奥村正樹所助教、福岡大学理学部化学科の安東勢津子講師(当時)らの研究グループによるもの。研究成果は「Communications Chemistry」に掲載されている。
画像はリリースより
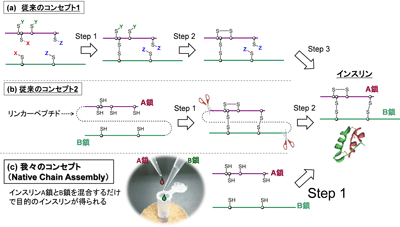
血糖値降下作用をもつインスリンは糖尿病患者が使用する静脈注射製剤として広く知られているが、インスリンは2本の異なるポリペプチド鎖が2対のジスルフィド結合とよばれる化学結合でリンクした特徴的な分子構造をもっており、その化学合成は容易ではない。インスリンの化学合成では、世界中の研究グループがさまざまな手法を試みてきたが、手法の煩雑さなどの理由からインスリン製剤の製造応用へ展開された例はなかった。
新しいインスリン製剤技術としての応用に期待
研究グループは2017年、システインの代わりにシステインの硫黄原子をセレン原子に置換したアミノ酸であるセレノシステインをA鎖とB鎖に組み込むことで、A鎖とB鎖が自発的にジセレニド結合(SeSe結合)で架橋し、天然型のインスリン(セレノインスリン)が効率的に得られることを報告している。今回は、単純かつ最も合理的な天然のA鎖とB鎖の自己組織化(Native Chain Assembly;NCA)を利用する技法を再考。インスリンが最も効率よく生成する条件を探索する中で温度やpHを綿密に検討したところ、マイナス10度、pH10.0の条件下でインスリンが良好な収率で得られることを明らかにした。さらに、生体内のタンパク質中のSS結合架橋を促す生体酵素(プロテインジスルフィド異性化酵素;PDI)をごく少量添加することで、反応時間の短縮と収率が向上することが確認された。反応溶液の高速液体クロマトグラフィー(HPLC)分析の結果から、出発物質であるA鎖とB鎖のピークが、反応後ではインスリンのピークに収束している様子が確認でき、ウシ膵臓インススリンの場合、最適条件下において最高収率は39%、同様にヒトインスリンでは49%、インスリンと同様の構造をもつ類似ペプチドホルモンであるヒト2型リラキシンでは47%の収率で得られたという。
今回開発された手法は、遺伝子工学的な手法を一切用いないために大掛かりな製造設備を必要とせず、A鎖とB鎖を約1:1で混ぜ合わせるというごく単純な操作で目的のインスリンを得ることができる。将来的には、化学合成技術を基盤とした新しいインスリン製剤技術としての応用が期待されると研究グループは述べている。
▼関連リンク
・東海大学 プレスリリース



