肝硬変患者ではロイシンなど分岐鎖アミノ酸濃度が低下
東京医科歯科大学は1月5日、肝がんがロイシン欠乏に対して耐性を獲得する分子メカニズムの一端を世界で初めて明らかにしたと発表した。この研究は、同大大学院医歯学総合研究科分子腫瘍医学分野の田中真二教授、島田周助教、秋山好光講師、水野裕貴大学院生らの研究グループによるもの。研究成果は「Scientific Reports」に掲載されている。
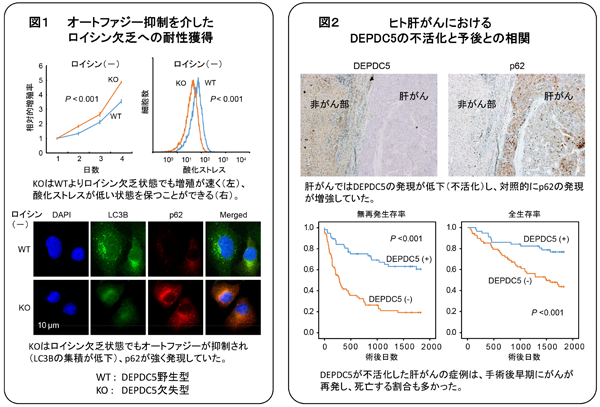
肝がんの発生母体である肝硬変の患者では、ロイシンなど分岐鎖アミノ酸濃度が低下することが知られている。がん細胞にとって逆境であるはずのロイシンが欠乏した状態で、肝がん細胞が増殖できるメカニズムは明らかになっていなかった。
DEPDC5欠失肝がん細胞では、ロイシン欠乏状態でもオートファジーが誘導されず
今回研究グループは、ヒト肝がん細胞のDEPDC5遺伝子をゲノム編集法で特異的に欠失させることで、ロイシン欠乏状態に対して強い耐性を持つがん細胞になることを明らかにしたという。通常、ロイシンが欠乏すると、飢餓状態に対する細胞応答としてオートファジーによるタンパク分解が起こるが、DEPDC5欠失肝がん細胞では、ロイシン欠乏状態でもオートファジーが誘導されないことが判明した。
画像はリリースより
その結果、オートファジーで分解されるはずのp62タンパクが細胞内にたまり、酸化ストレスに対する耐性が強くなることが示されたという。また、DEPDC5を発現誘導させたヒト肝がん細胞では、逆にp62の減少にともなって酸化ストレスに耐えられなくなり、腫瘍増殖が抑制されることが明らかになった。ヒト肝がんの臨床症例を用いた解析でも、DEPDC5が不活化した肝がんではp62の蓄積を認め、がん再発、がん死亡が多いことがわかったという。
DEPDC5は、ゲノムワイド関連解析によりC型肝炎に起因する肝がんの発生との関連も報告されている。がんのアミノ酸代謝については近年多くの発見があり、その解明による新たな治療法開発の可能性が注目されている。今回の成果もがんアミノ酸代謝における発見であり、慢性肝障害を合併した肝がんの新規治療薬開発につながると期待される、と研究グループは述べている。
▼関連リンク
・東京医科歯科大学 プレスリリース




