ヘルパーT細胞の一種、Th17細胞
東邦大学は2017年12月28日、多発性硬化症など自己免疫疾患の原因として注目されるリンパ球「Th17細胞」の分化に、転写因子「JunB」が必要であることを見出したと発表した。この研究は、同大医学部生化学講座の山﨑創准教授と九州大学の住本英樹教授ら研究グループによるもの。研究成果は、「Scientific Reports」に掲載されている。
画像はリリースより
免疫の司令塔とも呼ばれるヘルパーT細胞の一種であるTh17細胞は、感染防御に重要な役割を果たしている一方、さまざまな自己免疫疾患の原因ともなる。そのため、体内でTh17細胞の働きが正しく調節されることは非常に重要と考えられている。
近年、Th17細胞は多発性硬化症をはじめとする自己免疫疾患の発症に関与することから注目を集めているが、体の中でTh17細胞がどのようにできるかは、未解明な点が多かったという。
Th1細胞、Treg細胞などへの分化ではほとんど影響受けず
今回の研究ではまず、さまざまなヘルパーT細胞におけるJunBの発現を調査し、Th17細胞でその発現が高いと判明。JunB欠損マウスを作出してTh17細胞におけるJunBの役割を検討した。
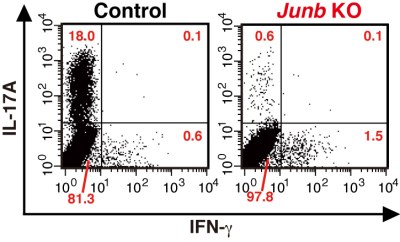
作成した全身性のJunB欠損マウスから取り出したナイーブCD4+ T細胞を用いて試験管内でTh17細胞への分化を誘導したところ、同腹のコントロールマウスに由来するナイーブCD4+ T細胞とは対照的に、IL-17を産生する細胞への分化がほとんど認められなくなった。JunBは一群の遺伝子の発現を調節すると予想されたため、Th17細胞への分化条件下で培養したJunB欠損CD4+ T細胞について遺伝子発現解析を行なったところ、Th17細胞のマーカーとされる遺伝子の発現誘導が軒並み低下。一方、Th1細胞、Th2細胞、Treg細胞への分化はほとんど影響を受けずに正常に起きていたことから、ヘルパーT細胞におけるJunBの役割はTh17細胞への分化過程に限定的であることがわかったとしている。
次にJunB欠損マウスに実験的自己免疫性脳脊髄炎(EAE)モデルを誘導し、自己免疫疾患の発症におけるJunBの役割を検討。その結果、これも同腹のコントロールマウスで病態が誘導されたのとは対照的に、JunB欠損マウスでは一例も発症せず、症状の原因となる脱髄や免疫細胞の浸潤も全く認められなかった。以上のことから、JunBはTh17細胞の分化に必須であるとの結論に至ったという。
今回の研究成果によって、JunBの質的・量的な調節を通じてTh17細胞の機能を変化させることにより、自己免疫疾患に対する新たな治療法を開発できる可能性が示された、と研究グループは述べている。
▼関連リンク
・東邦大学 プレスリリース



