ほとんど解明されていない白血病細胞の耐性獲得メカニズム
京都大学は12月4日、がん抑制遺伝子p53(TP53)と転写因子RUNX1と結合するパートナータンパク質CBFBが、RUNX1-抑制を含む抗がん剤治療により順次増強されることにより、結果的に急性骨髄性白血病細胞に薬剤抵抗性が誘導されるというメカニズムを解明したと発表した。この研究は、同大医学研究科の上久保靖彦准教授、足立壮一教授、森田剣ポスドク研究員、能浦三奈修士課程学生を中心とするグループが、理学研究科の杉山弘教授らと共同で行ったもの。研究成果は、英科学誌「Scientific Reports」に掲載されている。
画像はリリースより
転写因子RUNX1は、血液を作るのに必要な遺伝子を一括して制御している。また、白血病の発症や進行に重要な役割も担っているため、RUNX1抑制による白血病治療は有効な新規治療戦略であると広く認められつつある。
一方、RUNX1の抑制やその他現在の抗がん剤治療に対して、白血病細胞がどのように耐性を獲得し治療効果が薄れていくのか、そのメカニズムはほとんど解明されていない。特にRUNX1と結合するパートナータンパク質であるCBFBは、抵抗性獲得にどのように関わっているのかほとんどわかっていなかった。
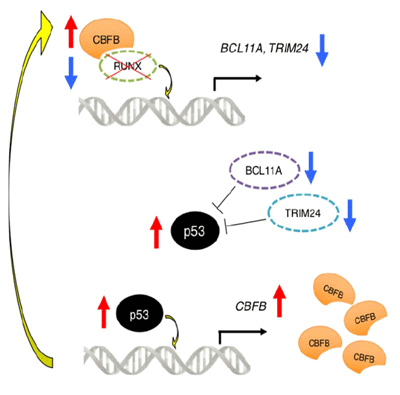
RUNX1-p53-CBFBフィードバックループを発見
これまでに、RUNX1を抑制すると、がん抑制遺伝子であるp53が活性化し、白血病細胞も抑えられるというメカニズムが報告されていた。今回の研究では、CBFBの転写発現を制御する領域にp53が直接結合し、CBFBタンパクの発現を直接増加させ、結果的にRUNX1を再び安定化するというフィードバック機構を発見。このループにより、RUNX1は抑制されにくくなり、RUNX1の抑制や他の抗がん剤による抗白血病効果を弱くしてしまうという。
また、多数の臨床例のサンプルを用いた既存データを解析したところ、治療後再発した急性骨髄性白血病患者例では、治療前初発診断時よりもCBFBの発現レベルが上昇しており、p53の発現量も同時に増えていたという。これは、白血病発症や白血病細胞の増殖維持に、RUNX1-p53-CBFBフィードバックループが重要な働きをしていることを示唆する結果であり、このフィードバックループを制御できれば、さらに効果的な新規治療戦略が立てられると考えられるとしている。
RUNX1などαファミリー因子が白血病などのがんを進行させるという報告は、近年増加傾向にあり、研究グループが提唱しているRUNX1-抑制コンセプトは、新規抗腫瘍戦略として注目されている。研究グループは、「RUNX1-p53-CBFBフィードバックループは潜在的な難治性白血病治療ターゲットとなりうるため、今後引き続きフィードバックループをターゲットとした研究開発を進めていく」としている。
▼関連リンク
・京都大学 研究成果




