52週投与後の369例の患者を解析
富士フイルム株式会社は7月19日、軽度から中等度のアルツハイマー型認知症(AD)患者を対象としたAD治療薬「T-817MA」の米国第2相臨床試験結果を発表した。
画像はリリースより
T-817MAは、富士フイルムグループの富山化学工業が見出したAD治療薬。シグマ受容体の活性化により、強力な神経細胞保護効果や神経突起伸展促進効果を示し、病態動物モデルで高い治療効果を発揮することが確認されている。
同試験では、ドネペジル塩酸塩やリバスチグミン経皮システムで治療している、軽度から中等度(認知機能の簡易検査MMSEのスコア:12~22点)のAD患者を対象に、高用量(448mg)、低用量(224mg)のT-817MAまたはプラセボを52週間投与。認知機能の評価項目のADAS-cogや全般的臨床症状改善度の評価項目ADCS-CGICを主要評価項目として、52週後の有効性と安全性をプラセボ対照二重盲検比較試験で検討した。52週間の投与を完了し、有効解析の対象となった患者は369例だった。
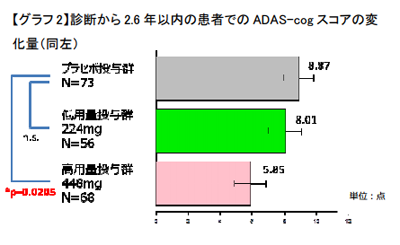
罹病期間が短い患者群で認知機能低下の進行を大幅抑制
認知機能を評価する尺度のADAS-cogスコアで、患者全体では有効性に対する仮説の検証にはいたらなかったものの、罹病期間が短い患者群(ADの診断から投薬開始までの期間が2.6年以内)でプラセボ投与群に対する認知機能低下の大幅な進行抑制が認められ、統計学的有意差を確認。また、T-817MA投与群では、用量依存的に脳脊髄液中のp-Tauが減少する傾向がみられ、なかでも高用量投与群ではプラセボ投与群に対し統計学的有意差を確認できた。さらにT-817MA投与群では、脳を立体的に測定するvolumetric MRI測定で海馬の萎縮が抑制される傾向があることも確認したという。
また、マサチューセッツ総合病院神経科副理事のRudolph Tanzi博士がマウスのミクログリア細胞に対するT-817MAの効果を確認する実験を実施。T-817MAが脳内のAβ除去に関わるミクログリア細胞に作用し、その働きを促進することがわかったという。
今後、富士フイルムは、FDA(米国食品医薬品局)を含めた規制当局と米国第2相臨床試験結果について協議し、第3相臨床試験に向けた検討を進めていくとしている。
▼関連リンク
・富士フイルム株式会社 ニュースリリース




