EBウイルス産物の中でも発がんへの関与が特に強いLMP1蛋白
北海道大学は3月7日、同大大学院薬学研究院の松田正教授らの研究グループが、がんウイルス産物の新たな分解制御機構を同定したと発表した。同研究は、生化学分野の専門雑誌「FEBS Letters」で、2月27日に公表されている。
画像はリリースより
がんウイルスとして知られるエプスタイン・バー(Epstein-Barr:EB)ウイルスは、ほとんどの成人に感染が認められるヘルペスウイルスで、上咽頭がん、ホジキンリンパ腫、胃がんなどへの関与が知られている。これらのがん細胞において、EBウイルスは潜伏感染状態であり、発現するウイルス遺伝子産物の機能が発がんに関与している。
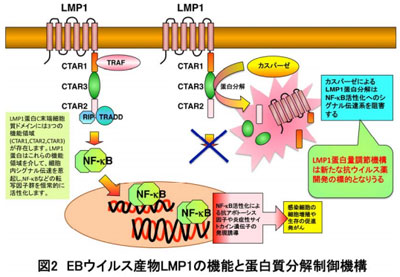
特に発がんとの関連が深いと考えられているのが、潜伏感染膜蛋白質1(Latent Membrane Protein 1:LMP1)だ。このLMP1蛋白は、感染細胞によるが1.5~7時間という短い半減期を示す蛋白で、これまでプロテアソーム蛋白分解系によるLMP1蛋白分解系の存在が報告されているが、その他のLMP1蛋白分解系の存在や、その詳細については未だわかっていなかった。そこで研究グループは、LMP1発現細胞に対して種々の蛋白分解酵素阻害剤処理や遺伝子ノックダウンをおこなうことにより、新たなLMP1蛋白分解系の存在を検討したという。
LMP1蛋白量調節機構を標的とした新たな抗ウイルス薬開発に期待
まず、LMP1を発現させた子宮頸がんHaLa細胞において、種々の蛋白分解酵素阻害剤で細胞を処理することにより、LMP1蛋白分解反応への影響を観察。するとプロテアソーム系分解酵素阻害剤やリソソーム分解酵素阻害剤での細胞処理に比べて、汎カスパーゼ蛋白分解阻害剤処理では有意にLMP1蛋白の分解が抑制された。次に種々のカスパーゼ蛋白分解酵素阻害剤を用いて検討したところ、カスパーゼ3に対する阻害剤での細胞処理で有意にLMP1蛋白の分解が抑制。さらにカスパーゼ3遺伝子ノックダウン処理した細胞でも有意にLMP1蛋白の分解が抑制されたという。
また、HeLa細胞へのLMP1蛋白発現誘導が細胞内のカスパーゼ3の活性化を誘導することも判明。LMP1蛋白分解抑制が感染細胞を模したLMP1を発現させたHaLa細胞にどのような影響を与えるかを、LMP1の標的である細胞内シグナル伝達系への影響を転写因子NF-Bの活性化を指標に検討したところ、カスパーゼ蛋白分解阻害剤処理やカスパーゼ3遺伝子ノックダウン処理をおこなったLMP1を発現させたHaLa細胞では、LMP1により誘導されるNF-Bの活性化並びに炎症性サイトカイン「IL-6」の産生が促進されていることもわかったという。
最後に、LMP1蛋白のどの部分がカスパーゼによる蛋白分解に関与するかをさまざまなLMP1変異体を作成することにより検討。その結果、LMP1蛋白のC末端細胞質ドメインの3つの機能領域のうち、これまであまり機能が知られていなかったCTAR3に存在する4つの反復する配列DNTDおよびC末側に存在するLMTDが、LMP1を発現させたHaLa細胞でのカスパーゼによるLMP1分解に関与することが示され、CTAR3のLMP1蛋白量調節における役割が初めて明らかになったという。
今回の研究成果は、今後LMP1蛋白制御を標的とする新たなウイルス治療薬の開発につながることが期待されると研究グループは述べている。
▼関連リンク
・北海道大学 プレスリリース






