治療抵抗性高く、30~40%に転移性再発見る悪性度高いがん
北海道大学は2月9日、脂質メディエーターであるリゾフォスファチジン酸(LPA)が、腎明細胞がんの主な悪性度促進因子であることを詳細な分子機構とともに明らかにしたと発表した。この研究は、同大学大学院医学研究科の佐邊壽孝教授、橋本茂特任准教授らの研究チームが、慶應義塾大学医学部の大家基嗣教授、三上修治専任講師らのグループと共同で行ったもの。
画像はリリースより
腎明細胞がんは、腎がんの70~80%を占め、抗がん剤や放射線療法に対して抵抗性が高く、その30~40%に転移性再発を見る極めて悪性度の高いがん。このがんは上皮組織に由来するが、転移性の高くなったものの多くは上皮様の形質を失い、浸潤能を獲得した間充織様形質に変化している。
がんの脅威はその浸潤能、転移性再発や治療抵抗にある。ヒトにおけるがんの多くは上皮組織に由来し、悪性度進展に伴い、上皮間充織形質転換に類似した事象が誘導され、高い浸潤性や転移性、場合によっては幹細胞的性質も獲得されると考えられている。また、最近の研究によって、がんの示す間充織形質が化学療法など様々な治療に対する抵抗性の本質であることが指摘されている。しかし、がん間充織形質の本体や、それを作動させる細胞内シグナル経路はこれまで不明だった。
Arf6経路因子群の高発現、悪性度や薬剤耐性診断するバイオマーカーに
北海道大学によると、共同研究グループは、これまで乳がん研究で培った研究手法と知識を腎がん研究に応用し、腎明細胞がんの悪性度進展を主導する根本的シグナル経路を解析。病理標本解析やその統計学的処理、動物実験も行い、得られた結果に対する多角的検討と確定を行った。
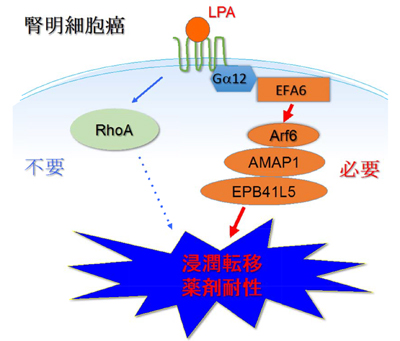
その結果、腎明細胞がんにおいて、LPAがG蛋白質共役受容体(7回膜貫通型受容体)を介してArf6を活性化し、間充織特異的蛋白質因子を含有する悪性度進展を促す分子機構を明らかにした。これまで、LPAはRhoを活性化することによってがん悪性度に関与すると考えられていたが、今回、LPAによるがん悪性度進展にはRho活性は必要ではないことも明らかにした。Arf6経路を遮断すると、腎明細胞がんの浸潤転移を強く阻害し、薬剤耐性も著しく軽減することができた。また、病理標本解析から、Arf6経路因子群の高発現は患者予後不良と非常に強い統計的相関を示し、腎明細胞がんの悪性度や薬剤耐性を診断するための優れたバイオマーカーとなることも分かった。
今後、腎がん患者の末梢血がん細胞や転移部での解析も予定しており、過剰で無駄な治療を避け、効率の良い効果的治療法の開発につながるものと研究グループは述べている。
▼関連リンク
・北海道大学 プレスリリース




