時空間的に制御された極性生長の過程を明らかに
筑波大学は11月14日、同大学生命環境系国際テニュアトラックの竹下典男助教(現・カールスルーエ工科大学応用微生物学科グループリーダー兼任)および、カールスルーエ工科大学応用物理学科のUlrich Nienhaus教授らの研究グループが、超解像顕微鏡により、細胞の極性が維持される機構を可視化することに成功したと発表した。同研究の成果は、「Science Advances」に11月13日付で掲載されている。
画像はリリースより
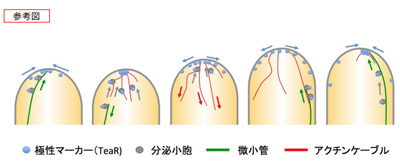
細胞の極性はさまざまな細胞の機能に必須であり、極性に従った生長によって、機能に適した細胞形態が形成される。具体的には、極性マーカーが極性部位を決定し、そこに向かって膜小胞が運ばれることにより、部位特異的な生長がもたらされる。しかし、膜小胞の融合によって形質膜が伸長する際、伸長する形質膜上でどのように極性マーカーが拡散せず維持されるのかという疑問があった。
今回の研究は、従来の蛍光顕微鏡では可視化できなかった極性マーカーの挙動を、超解像顕微鏡の1つであるPALM(photoactivation localization microscopy)により明らかにしたものである。
一時的な極性の確立を繰り返すことが鍵
この研究で明らかとなった主な点は、菌糸状の形態を持つ真菌(糸状菌Aspergillus nidulans)をモデルに、超解像を含む蛍光顕微鏡によるイメージングを用いて極性マーカーの挙動を可視化し、エキソサイトーシス(膜小胞の形質膜への融合)や微小管との関わりを明らかにしたことである。
細胞の極性は、微小管と形質膜の相互作用により一時的に確立されるが、エキソサイトーシスによる極性生長が起きる際に極性が拡散してしまうことが示されたという。このような一時的な極性の確立を繰り返し、時空間的に制御された過程が繰り返されることで、極性生長が効率的に起こることが明らかになった。また、数理モデルを用いたシミュレーション解析により、同研究グループモデルの妥当性が支持されたとしている。
今回の結果は、細胞一般における細胞極性と形態形成の根本的な制御機構の理解に役立つことが期待される。また、ある糸状菌群は動植物や農作物への病原性を示し、一方で、その高い酵素分泌能から食品、酵素生産などの産業で利用されている糸状菌もある。糸状菌の感染能と高い分泌能は、菌糸状の形態と密接に関連しているため、糸状菌の極性生長の機構を解析することは、医薬・農薬開発上、産業上への応用に繋がることも期待できると、研究グループは述べている。
▼関連リンク
・筑波大学 プレスリリース






