自己免疫疾患を引き起こす根本的な原因や正確なメカニズムは不明
国立医薬基盤・健康・栄養研究所(NIBIOHN)は10月29日、病原性CD4陽性T細胞に発現するマイクロRNAが、ケモカイン受容体の発現を制御し、自己免疫疾患発症に関与していることを発見したと発表した。この研究は、NIBIOHN生体機能分子制御プロジェクトの飯島則文サブプロジェクトリーダーらと、北海道医療センターの新野正明臨床研究部長、大阪大学大学院歯学研究科の山口雅也バイオインフォマティクス研究ユニットリーダー/准教授、同大学院医学系研究科、東京大学医科学研究所との共同研究によるもの。研究成果は、「Journal of Autoimmunity」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
自己免疫疾患は、自己抗原に反応する制御不能な免疫系が特定の組織を破壊し、重篤な障害を引き起こす病的状態であり、その発症率は年々増加している。性別、遺伝、肥満、喫煙、有害物質への曝露、特定の薬剤、感染症などの潜在的な危険因子が予測されているが、自己免疫疾患を引き起こす根本的な原因や正確なメカニズムは依然として不明だ。
臓器特異的な自己免疫疾患として、多発性硬化症や慢性関節リウマチ、バセドウ病、潰瘍性大腸炎、クローン病などが知られているが、それぞれの組織に発現する抗原を認識するCD4陽性T細胞の活性化が検出されており、組織に傷害を与えるT細胞として「病原性T細胞」と呼ばれている。このような自己反応性T細胞がどのようにして活性化するのか、詳細なメカニズムは依然として不明だ。そこで研究グループは今回、病原性T細胞がどのようにして分化するのか、病原性T細胞に特徴的に発現する分子の探索を介して、自己免疫疾患の治療標的を明確にすることを目的とした。
IFA添加多発性硬化症モデルのCD4陽性T細胞で、miR-147-3pが高発現
自己免疫疾患を誘導する実験動物モデルでは、自己に発現する抗原を結核菌死菌とIFAという2種類のアジュバントと組み合わせて実験動物に接種すると、さまざまな自己免疫疾患を誘導できることが知られている。今回は、主に自己抗原としてミエリンオリゴデンドロサイト糖タンパク質(Myelin Oligodendrocyte Glycoprotein:MOG)を選択し、MOG+結核菌死菌+IFAをマウスに接種して「多発性硬化症」と同様の症状が再現できる実験的脳脊髄炎モデルを用いて、病原性CD4陽性T細胞の分化や、病原性CD4陽性T細胞に特異的に発現する遺伝子・分子の探索を行った。
先行研究では、結核菌の死菌と自己抗原だけでは自己免疫疾患が誘導されず、IFAとともに接種することで、自己免疫疾患の症状が誘発されることを発見した。そこで、まずIFAの添加がどのようにして自己免疫を活性化させるのか、そのメカニズムの解明を目指した。最初に、IFAの添加により病原性を有する自己反応性CD4陽性T細胞に発現する細胞群(CXCR6陽性およびSLAMF6陰性)の割合が、所属リンパ節で増大していること見出した。
次に、その所属リンパ節で、IFAを添加した場合としない場合で所属リンパ節の自己反応性CD4陽性T細胞に発現する遺伝子群を解析したところ、IFAを添加した場合にこれらのCD4陽性T細胞でマイクロRNA、miR-147-3pが高発現することを明らかにした。
miR-147-3p、病原性CD4陽性T細胞に発現するケモカイン受容体CXCR3の発現抑制
加えて、神経組織に侵入するCD4陽性T細胞群を解析したところ、病原性の高いCD4陽性T細胞群(CXCR6陽性およびSLAMF6陰性)にmiR-147-3pが高発現していることがわかった。さらに、CRISPR/Cas9システムによる遺伝子編集により自己反応性特異的CD4陽性T細胞のmiR-147-3p発現を抑制すると、自己免疫疾患の誘導が抑制された。
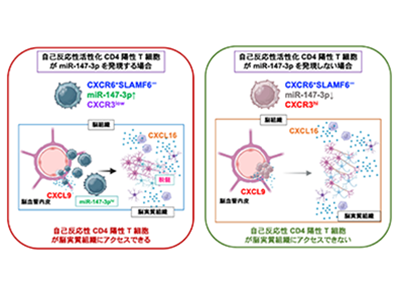
そこで、病原性CD4陽性T細胞に発現するmiR-147-3pの作用機序を詳細に解析したところ、miR-147-3pはCD4陽性T細胞の分化には影響せず、病原性CD4陽性T細胞(CXCR6陽性およびSLAMF6陰性)に発現するケモカイン受容体CXCR3の発現を抑制することが明らかとなった。
miR-147-3pを標的とした自己免疫疾患に対する新規治療薬開発に期待
多発性硬化症の患者の脳実質組織ではCXCL16(CXCR6のリガンド)の分泌が亢進しており、そのため血中からCXCR6を発現する病原性CD4陽性T細胞が脳実質組織へ遊走し、神経細胞が傷害される。多発性硬化症の患者では、血液脳関門に局在する脳血管内皮細胞で、CXCL9(CXCR3のリガンド)の発現亢進が認められているが、miR-147-3pによってCXCR3の発現が抑制されている病原性CD4陽性T細胞はCXCL9の作用を受けないため、脳血管周囲に滞留することなく脳実質組織に浸潤して神経細胞を障害する。このようなメカニズムは、多発性硬化症に限らず他の自己免疫疾患の病態にも関与していると考えられ、病原性CD4陽性T細胞に発現するmiR-147-3pを標的とした新規自己免疫疾患治療方法が確立されることが期待できる。
今後、病原性CD4陽性T細胞に発現するマイクロRNA「miR-147-3p」がケモカイン受容体「CXCR3」を制御するメカニズムを解明することで、マイクロRNA「miR-147-3p」を標的とした自己免疫疾患に対する新たな治療薬の開発につながることが期待される、と研究グループは述べている。
▼関連リンク
・国立医薬基盤・健康・栄養研究所 プレスリリース



