p53変異を持つ急性赤白血病、白血病治療薬がほとんど効かず極めて予後不良
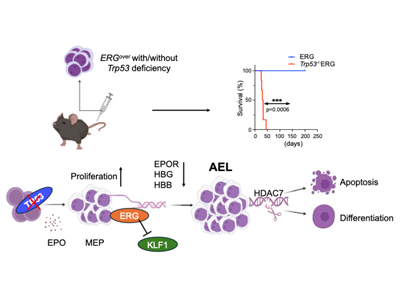
東京大学は9月15日、p53ノックアウトマウスから採取した骨髄細胞に転写因子ERGを導入して移植することにより、難治性で知られるヒト赤白血病の病態を再現したマウスモデルを作製したと発表した。この研究は、同大大学院新領域創成科学研究科メディカル情報生命専攻先進分子腫瘍学の合山進教授、張分宇(ちょうぶんう)特任研究員(研究当時)、北村俊雄名誉教授らの研究グループによるもの。研究成果は、「Leukemia」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
急性赤白血病は、幼弱な赤芽球の増殖を特徴とする白血病である。最近のゲノム解析により、赤芽球系白血病細胞の割合が8割を超える難治症例の大部分でがん抑制遺伝子p53の変異が認められ、また転写因子ERGの高発現が高頻度に共存することが明らかとなっている。p53変異を持つ赤白血病は、現在の白血病治療薬がほとんど効かないため予後が極めて悪く、臨床上の大きな問題となっている。
p53ノックアウトマウス由来の骨髄細胞に転写因子ERGを導入し、赤白血病細胞を作製
研究グループは、この難治性赤白血病に対する新しい治療法の開発を目的として、赤白血病の病態を再現するマウスモデルの作製と赤白血病の治療を可能とする新しい治療標的の探索に取り組んだ。
ヒト赤白血病の病態を再現し、かつ遺伝子操作を容易に行うことのできるマウスモデルを作製するため、Cas9発現マウスとp53ノックアウトマウスを交配したp53-/-/Cas9マウスから採取した骨髄細胞に転写因子ERGを導入し、試験管内で培養可能で、マウス内で赤白血病を発症し、かつ任意の遺伝子を簡便にノックアウトすることのできるCas9発現赤白血病細胞(Cas9/ERG発現p53欠失細胞:CEP53細胞と命名)を作製した。
ERGによる赤血球分化抑制とp53欠失による赤血球系細胞増殖促進が協調し発症を誘導
また、このCEP53細胞や赤血球系のヒト白血病細胞を用いてRNA-Seq解析やChIP-Seq解析を行い、転写因子ERGが赤血球系遺伝子の発現抑制を介して赤血球分化を抑制すること、p53欠失が赤血球系細胞の増殖を促進すること、両者が協調することで赤白血病の発症を誘導することを明らかにした。
ヒストン脱アセチル化酵素HDAC7の欠失、赤白血病の発症を抑制
そして、赤白血病細胞の増殖・分化を制御する分子としてヒストン脱アセチル化酵素HDAC7を同定し、HDAC7欠失がヒト赤白血病細胞やCEP53細胞の分化を誘導し、赤白血病の発症を抑制することを見出した。ただし、HDAC7の酵素活性は赤白血病細胞の増殖には必要なく、HDAC7はヒストン脱アセチル化以外の機能を介して赤白血病細胞の増殖を促進していると考えられる。
HDAC7の分解誘導、赤白血病の画期的な治療薬開発につながる可能性
今回の研究で樹立したCEP53細胞は、今後赤白血病研究を進める上で貴重な実験ツールになると考えられる。「HDAC7分解誘導薬を開発すれば、難治性で知られる赤白血病に対する画期的な治療薬となることが期待される」と、研究グループは述べている。
▼関連リンク
・東京大学大学院新領域創成科学研究科 記者発表




