AMLなどに頻用されているが根治的な治療となっていない
東京大学医科学研究所は8月29日、血液悪性腫瘍の治療に用いられるDNAメチル化阻害剤の耐性に関わる分子として、ユビキチンE3リガーゼTOPORSを同定したと発表した。この研究は、研究所附属幹細胞治療研究センター幹細胞分子医学分野の岩間厚志教授、同所癌防御シグナル分野の中西真教授、西山敦哉准教授らの研究グループによるもの。研究成果は、「Nature Communications」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
高齢者の血液悪性腫瘍に対する治療成績は大きく改善しておらず、高齢化の進む日本において重要な課題となっている。アザシチジンやデシタビンに代表されるDNAメチル化阻害剤は、従来の化学療法に比して副作用が少なく、高齢者の急性骨髄性白血病や骨髄異形成症候群などの血液悪性腫瘍に頻用されている。しかし、ほとんどの症例で根治的な治療とならないため、その作用を増強させる治療戦略が求められている。
ユビキチンE3リガーゼのTOPORS遺伝子KOで、DNAメチル化阻害剤の効果増強
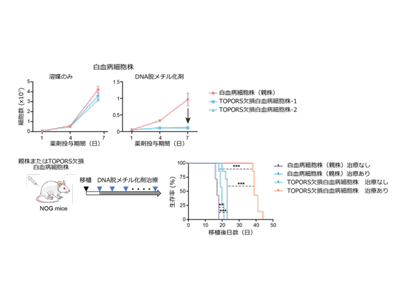
研究では、まずDNAメチル化阻害剤の作用増強に関わる遺伝子を同定するために、CRISPR/Cas9システムによるスクリーニングを行った。Cas9を発現した血液腫瘍細胞株とsgRNAライブラリーを用いた探索の結果、ユビキチンE3リガーゼであるTOPORS遺伝子のノックアウトにより、DNAメチル化阻害剤の効果が増強されることがわかった。
TOPORS<DNA-DNMT1をユビキチン化・分解<DNAメチル化阻害剤の効果抑制
DNAメチル化阻害剤はシトシン類似の構造を有し、DNAに取り込まれた後にメチル化維持を担うDNMT1を捕捉する。このDNAとDNMT1の架橋構造により、腫瘍細胞における有糸分裂が障害されることが抗腫瘍効果機序の一つであると考えられている。今回の研究では、野生株と比べて、TOPORSノックアウト細胞ではDNAメチル化阻害剤の投与後にDNAとDNMT1の架橋構造が多く残存し、有糸分裂がより強く障害された。また、TOPORSノックアウト細胞では、DNAメチル化阻害剤の投与後にDNMT1のユビキチン化修飾が減少していた。これらの結果から、TOPORSはDNAに捕捉されたDNMT1をユビキチン化し分解に導くことで、DNAとDNMT1の架橋構造の残存を防ぎ、DNAメチル化阻害剤の効果を減弱していると考えられた。DNAメチル化阻害剤の暴露後にDNAに捕捉されたDNMT1は、高度にSUMO化される。TOPORSはSUMO化部位との相互作用に必要な部位を複数有しており、DNAメチル化阻害剤の暴露後にDNAと架橋構造を形成したSUMO化DNMT1をユビキチン化の標的とすることで、DNAメチル化阻害剤に対する耐性に寄与していると考えられる。
DNAメチル化阻害剤+ユビキチン化阻害剤、効果の高い治療戦略となる可能性
さらに、血液腫瘍細胞に対してDNAメチル化阻害剤とユビキチン化阻害剤を併用すると、架橋されたDNMT1の分解が遅れ、DNAメチル化阻害剤単剤より強い効果を示した。急性骨髄性白血病患者の検体を免疫不全マウスに移植し、DNAメチル化阻害剤とユビキチン化阻害剤との併用療法を行ったところ、高い治療効果も得られた。これらの結果から、ユビキチン化阻害剤とDNAメチル化阻害剤の併用は血液悪性腫瘍に対してより効果の高い治療戦略である可能性が考えられた。
「研究結果は、これまで治療効果が不十分であったDNAメチル化阻害剤を用いた血液悪性腫瘍の治療における新たな治療戦略につながることが期待される」と、研究グループは述べている。
▼関連リンク
・東京大学医科学研究所 プレスリリース



