IgA腎症にリーキーガットが関連すると考えられていたが詳細は不明だった
慶應義塾大学は8月5日、腸上皮バリアの破綻とIgA腎症との関連を、新規マウスモデルで実証したと発表した。この研究は、同大大学院薬学研究科の木梨祐輔氏(後期博士課程3年)、同大薬学部の木村俊介准教授、長谷耕二教授を中心とする研究グループと、同大医学部、福島大学、静岡県立大学、理化学研究所との共同研究によるもの。研究成果は、「eBioMedicine」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
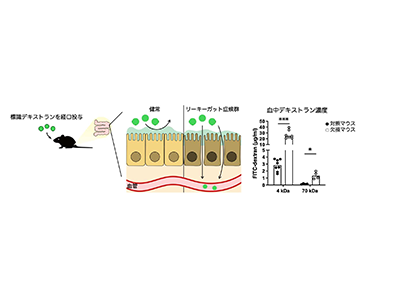
消化吸収を行う腸管には食事により摂取された食物抗原や病原体などが存在し、これらの異物が体内へ侵入するのを防ぐシステムが必要となる。腸管腔内面を覆う上皮細胞は互いに強固に接着することにより物理的な障壁となるとともに、粘液や抗菌ペプチドの産生、IgA抗体の分泌など化学的、生物学的な防御システムを構築している。この腸上皮バリア機能の低下によって、管腔内の異物が血中へと移行し、ヒトの身体にさまざまな影響を及ぼすと考えられている。このような状態は「リーキーガット(腸漏れ)」と呼ばれている。リーキーガットは自己免疫疾患やアレルギー疾患、肥満などの疾患と関連している可能性が指摘されているが、実際にリーキーガットがこれらの疾患の発症原因か否かは明らかになっていなかった。
IgA腎症は慢性糸球体腎炎の一つで、血液中の老廃物や塩分のろ過装置である糸球体に炎症が生じ、機能が低下する疾患だ。病気が進行した場合は透析や腎移植が必要となることがある。糸球体へのIgA抗体の沈着が炎症の原因だが、なぜIgAが沈着するかは不明だった。さらに、IgA腎症はリーキーガットとの関連が示唆されながら、因果関係が明らかになっていなかった疾患の一つでもある。
AP-1Bは上皮細胞内のタンパク質輸送に関与する分子として発見された。研究グループはこれまでに、AP-1Bが腸上皮細胞において、免疫応答に重要な生理活性タンパク質(サイトカイン)受容体の輸送、細胞増殖の制御に寄与することを明らかにしてきた。
腸上皮細胞のAP-1B欠損で腸上皮バリア機能低下、リーキーガット類似症状を確認
今回の研究では、薬剤処理により腸上皮細胞からAP-1Bを欠損させたマウスを作製し、AP-1B欠損が腸上皮バリア機能にどのような影響を与えるかを詳細に解析した。腸上皮バリアの評価に用いられるデキストランは、腸管バリア機能が正常な場合は腸管透過性が低く、経口摂取してもほとんど血中に移行しない。しかし、AP-1B欠損は血中デキストラン濃度を顕著に増加させた。また、AP-1B欠損マウスの腸管では抗菌ペプチド産生量の低下、管腔内IgA濃度の低下が認められた。
これらの結果から、腸上皮細胞におけるAP-1B欠損は腸上皮バリア機能を低下させ、リーキーガットと似た症状を招くことが明らかになった。
腸上皮バリア機能の維持にAP-1Bが重要である可能性
続いて、なぜAP-1B欠損によって腸上皮バリア機能の低下が引き起こされるかを明らかにすべく解析を進めた。その結果、AP-1B欠損マウスでは、抗菌ペプチドの産生を制御するサイトカインであるインターロイキン-22(IL-22)シグナルの低下、管腔内へのIgA分泌を担う多量体免疫グロブリン受容体(pIgR)の発現を誘導するIL-17シグナルの低下が認められた。
さらに、pIgRタンパク質自体が腸上皮細胞内で凝集する様子が観察された。したがって、AP-1Bはこれらのサイトカインシグナルの伝達に必要な受容体およびpIgRの細胞内輸送を制御しており、腸上皮バリア機能の維持に重要な因子であることが示唆された。
腸上皮バリア機能低下によるリーキーガットがIgA 腎症を引き起こすことをマウスで確認
AP-1B欠損マウスでは腸管腔におけるIgAは減少傾向である一方で、血中においては顕著に増加していた。ここから、IgAが腸管から血流を経て腸管外に影響を及ぼすのではないかと想定された。そして、全身組織の解析を進めたところ、腎臓の糸球体にIgAが沈着していることを見出した。糸球体にはIgAとともにIgGと補体因子C3も検出された。これはIgAがただ沈着しているのではなく、免疫複合体を形成していることを示している。さらには、AP-1B欠損マウスの血中IgAでは、IgAの正常な立体構造形成に必要なガラクトース修飾の減少が認められ、これにより免疫複合体の形成が引き起こされたと考えられた。
これらの異常はIgA腎症で認められる特徴に類似している。一方で、尿中タンパク質などは検出されないことから、IgA腎症としての症状は軽く、発症前か初期の段階であると推察された。
抗生物質による腸内細菌除去でIgAガラクトース修飾改善、腎糸球体へのIgA沈着抑制
最後に、ガラクトース欠損IgAの産生源や原因の解明を目指した。まず、腸管に存在する抗体産生細胞を分取し、ガラクトース転移酵素ファミリー遺伝子の発現量を測定したところ、AP-1B欠損マウスでは複数のガラクトース修飾酵素の遺伝子発現が低下していた。また、AP-1B欠損マウスの腸管組織を培養後、上清中のIgAを回収して、健常マウスの静脈内に投与する実験を行った。その結果、AP-1B欠損マウスの腸管由来IgAの投与によって、腎糸球体へのIgA沈着が確認された。これらの結果は、腎糸球体のIgA沈着の原因が腸管にある可能性を示している。
さらに、AP-1B欠損マウスでは腸上皮バリア機能の低下による腸内細菌叢の構成異常(ディスバイオ―シス)が認められた。リーキーガットでは腸内細菌の菌体成分や代謝物が体内へ移行し、腸管免疫系を活性化させると考えられている。そこで、抗生物質の投与により腸内細菌を除去すると、IgAのガラクトース修飾が改善し、腎糸球体へのIgA沈着も抑制することが明らかになった。
腸内細菌の制御がIgA腎症の治療に有効である可能性
今回の研究により、リーキーガットがIgA腎症の発症原因となり得ることがモデル動物により証明された。さらに、腸内細菌の制御がIgA腎症の治療に有効である可能性も示された。
「今後、研究のさらなる発展により、IgA腎症の発症機序の全容解明に、また腸管をターゲットにしたIgA腎症の治療法の開発に貢献できると考えられる」と、研究グループは述べている。
▼関連リンク
・慶應義塾大学 プレスリリース



