COVID-19治療薬、特効薬と言えるほどのものはまだない
京都大学は7月30日、新型コロナウイルス感染症(COVID-19)治療用の多能性幹細胞由来キラーT細胞製剤の作製に世界で初めて成功したと発表した。この研究は、同大医生物学研究所の河本宏教授、藤田医科大学、大阪大学、国立成育医療研究センター研究所らの研究グループによるもの。研究成果は、京都大学、藤田医科大学、大阪大学、国立成育医療センターの4者により特許出願中。また、この技術に基づいた開発研究は、引き続き出願人である4者とリバーセル株式会社が共同で行い、臨床試験は藤田医科大学で行う計画。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
COVID-19は、一時期ほどは脅威でなくなったが、高齢者や基礎疾患を持っている患者、あるいは免疫不全状態の患者においては、依然として致死的な転帰をもたらす恐ろしい感染症である。COVID-19に対して、さまざまな抗ウイルス薬が開発されたが、特効薬と言えるほど切れ味の良いものはまだない。抗体医薬は、感染初期にしか効果がなく、また変異株に対しては往々にして効果がなくなる。従って、重症COVID-19患者に使える治療薬の開発が望まれている。
多能性幹細胞由来TCR-T/CAR-T細胞療法、ウイルス感染症に応用可能か
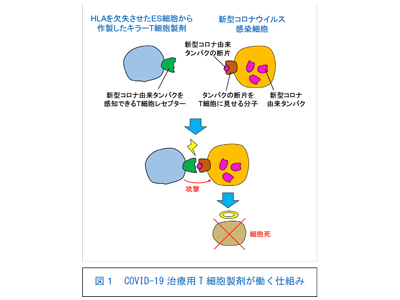
研究グループはこれまでに、患者の末梢血中のT細胞にがん抗原特異的なT細胞レセプター(TCR)遺伝子を導入するTCR-T細胞療法や、キメラ抗原レセプター(CAR)を導入するCAR-T細胞療法において、ES細胞やiPS細胞などの多能性幹細胞からT細胞を作製する方法を用いる研究を進めてきた。それによってこれらの治療法の課題とされてきた「作製できる細胞数に限りがある」「製造に時間やコストがかかる」「患者から品質の良いT細胞が得られるとは限らないので品質が不安定」などを解決できると考えた。開発したキラーT細胞製剤を作製する技術では、多能性幹細胞にあらかじめTCR遺伝子やCAR遺伝子を導入しておき大量生産することにより、必要なだけの細胞数を得ることができ生産コストの低減が可能となる上、凍結保存が可能で、解凍後すぐに投与できるため必要な時に即座に投与することができる。また、特定のHLA型を持つiPS細胞や、HLAを欠失させたES/iPS細胞を用いることで、拒絶反応の問題を軽減することができる。現在、最初の臨床応用としてWT1抗原を発現する急性骨髄性白血病を対象として、医師主導治験に向けた開発研究を進めている。
さらに、研究グループは、汎用性T細胞製剤を用いた治療法は、がんだけでなく、ウイルス感染症にも使えると考えてきた。細胞傷害性T細胞の本来の役割はウイルス感染細胞を殺傷する事であり、むしろがんの場合よりも顕著な効果を期待できる。実際に、造血幹細胞移植後に起こる致死的なウイルス感染症に対して「第三者のT細胞を材料にして、体外でウイルス抗原特異的T細胞を増幅してから投与する」方法では、有効性と安全性が示されている。
これまでに、COVID-19に対するワクチンが開発され、治療薬として抗ウイルス薬や抗体製剤が開発されたが、T細胞製剤は開発されていない。その理由として、患者自身のT細胞に遺伝子を導入する治療法は、投与するまでに数週間かかり急性に進行する感染症には間に合わないこと、また第三者の細胞を使う方法は、患者が重度の免疫不全状態にある場合に使え、新型コロナ感染症患者は免疫がある程度低下しているケースはあるかもしれないが、基本的には免疫能は正常であり、他人のT細胞を投与すると、すぐに拒絶されてしまうといったことがあった。
そのような中、研究グループはこれまでに開発してきた独自の技術に基づき、COVID-19に有効なT細胞製剤を作製することが可能と考えた。その技術の一つは「TCR遺伝子を多能性幹細胞に導入して材料となる細胞を作る」方法で、もう一つは、「多能性幹細胞から高品質なキラーT細胞を作る」方法である。これらの技術は、特許として、前者は日本・欧州・豪州、後者は日本・欧州・米国・豪州他で成立している。
日本人に多いHLA型の人をドナーとし、スパイクタンパク質特異的TCRをクローニング
研究グループはまず、日本人に多いタイプのHLAに合うTCRをクローニングするために、まず新型コロナウイルスワクチン接種歴のある健常ボランティアドナーのHLAタイピングを行った。その中で、日本人に多いHLA-A2402あるいはHLA-A0201を持っている人をドナーとした。次に、それらのドナーから末梢血単核球を採取し、テトラマー(特定のTCRに抗原特異的に結合できる試薬)を用いてスパイク(S)タンパク質特異的なTCRを発現するT細胞を分離した。T細胞をシングルセルレベルで精製した上で、PCRでcDNAを増幅してクローニングした。HLA-A2402に対応するTCRを3種類、HLA-A0201に対応するTCRを2種類得た。
HLAノックアウトES細胞株から、新型コロナ特異的TCR発現キラーT細胞作製
材料として使うES細胞は、拒絶されにくいように、ゲノム編集法を用いて、ES細胞株のHLAをノックアウト(KO)した。クラスIを発現できなくするためにB2M遺伝子を、クラスIIを発現できなくするためにCIITA遺伝子をKOした。T細胞に分化誘導させるためは、材料であるES細胞に何らかのTCRを導入しておく必要がある。ここでは既知のTCR遺伝子を、レンチウイルスを用いてHLA-KO-ES細胞に導入した。このTCR遺伝子はがん抗原であるNY-ESO1に特異的なTCRで、ウイルス感染細胞の感知はしない。こうして作製したES細胞から、キラーT細胞を作製した。
その後、クローニングしたTCR遺伝子をレトロウイルスに組み込み、再生キラーT細胞に導入した。従って、このT細胞はNY-ESO1-TCRと新型コロナTCRの2種類のTCRを発現しているが、NY-ESO1-TCRは正常細胞には無害なTCRであり、安全に使えるとしている。
作製キラーT細胞、共培養したSタンパク質発現細胞を殺傷
作製した再生キラーT細胞と、新型コロナのSタンパク質を強制発現させた標的細胞(肺胞上皮細胞株)とを共培養し、10分ごとに12時間連続撮影した。
その結果、作製した再生キラーT細胞は、Sタンパク質を発現した細胞のほとんどを殺傷した。感染細胞を用いたテストではないが、新型コロナ由来タンパク質を発現した細胞を殺傷したため、機能としては十分評価できたと研究グループは考えている。なお、実際の感染細胞を用いて細胞傷害活性を測定する実験も進めている。
臨床試験に向けた細胞作製から有効性・安全性検証を実施予定
今回特許出願の中で示したT細胞製剤は、研究用に作製したものであるため、そのまま臨床試験で使えない。出発点であるES細胞は臨床応用にも使える細胞だが、「HLAを欠損させる」「TCR遺伝子を導入する」「T細胞を作製する」などの工程を、臨床試験に使えるレベルで再度行う必要があり、最初の臨床試験まで3年くらい要する。なお、今回の実験では「再生T細胞にコロナ特異的TCR遺伝子を導入する」方法をとったため、ES細胞に既知のTCR遺伝子を導入したが、臨床試験に向けては、新型コロナ特異的TCRを直接ES細胞に導入する方法を取る予定。
有効性と安全性の検証に関しては、GMPグレードの細胞製剤施設で作製した細胞を用いて、あらためて行う。有効性についてはウイルス感染細胞を殺傷できるかという確認試験、安全性については、(i)投与した細胞が患者の細胞を攻撃してしまわないか、(ii)投与した細胞ががん化しないか、という2点について検証する。(i)に関しては異なるHLA型の細胞に反応しないということを、作製したT細胞をさまざまなHLA型の細胞と共培養することであらかじめテストする。(ii)に関しては、作製したT細胞を免疫不全マウスに輸注して、長期間の経過観察を行い、がん化が起こっていないかどうかを検証する。
対象になる患者は、基本的には重症例、あるいは重症化のリスクが高いと判断された症例が考えられている。「最初の臨床試験は、免疫不全状態になった患者で起こる難治性のCOVID-19を対象にして、藤田医科大学の血液内科で施行する計画である」と、研究グループは述べている。
▼関連リンク
・京都大学 最新の研究成果を知る




