腎臓深部のATPを評価する方法は存在しなかった
京都大学は7月9日、腎臓全領域におけるエネルギー動態の可視化に成功したと発表した。この研究は、同大医学研究科 腎臓内科学の柳田素子教授(兼・高等研究院ヒト生物学高等研究拠点(WPI-ASHBi)主任研究者)、山本恵則 ASHBi 特定研究員(研究当時、現:京都大学医学部附属病院 腎臓内科学 特定病院助教)らの研究グループによるもの。研究成果は、「Kidney International」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
腎臓病は成人の8人に1人が罹患する新たな国民病とも言われているが、有効な治療法の開発は遅れており、腎臓の機能が廃絶し透析療法が必要となる患者の数は年々増えてきている。そのため、腎臓病の病態メカニズムを解明し新たな治療法を発見することは喫緊の課題と考えられる。また、腎臓は生体内で最も酸素を消費する臓器の一つで、非常に多くのエネルギーを産生し消費している。腎臓の大きな役割として血液中に蓄積した老廃物や過剰な水分やミネラルを尿の中に排泄することが挙げられる。腎臓はこの体液の恒常性の維持のために多量のエネルギーを消費している。
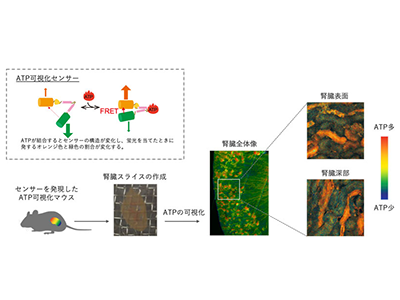
研究グループは腎臓病において「エネルギー不足が起こり、腎臓が機能不全に陥っているのではないか」との仮説を立てた。アデノシン三リン酸(ATP)は全ての生物に共通する「エネルギー通貨」とも呼ばれる重要な分子だが、これまで次々と産生され消費されてゆくATPの動態を可視化する技術がなかったため、詳細は謎に包まれていた。その謎を解くため、研究グループはこれまでに、細胞内ATP濃度を可視化するFRETバイオセンサーを全身発現させたATP可視化マウスを作成し、ATP可視化マウスと特殊な顕微鏡を用いることでATPの動態を高解像度かつリアルタイムに捉えることに成功している。しかし、この方法の技術的な制約として、腎臓のごく表層のATPしか評価できなかった。腎臓の深部には血液の濾過の中心的な役割を担う糸球体(特に重要な細胞が足細胞と呼ばれる)や、腎臓病のメカニズムを理解する上で重要となる部位が存在するため、腎臓全領域における評価方法が必要だと考えられる。
腎臓スライス片を用いた全領域ATP動態観察が可能な系の確立に成功
研究グループは今回、ATP可視化マウスの腎臓を取り出し、冷却した培養液の中で専用の機器を用いて300µm厚の薄い腎臓のスライス切片を作成。この腎臓のスライス切片が、生体内と同様にATP産生が保たれるような培養条件を検証し、腎臓の全領域のATP動態の観察が可能な系の確立に成功した。
最近、FDAは医薬品承認のための動物実験要件を撤廃したが、この背景には動物愛護の観点がある。これにより、動物実験を臓器チップやオルガノイドなどの実験で代替できるようになった。しかし現在のところ、代替法はまだ動物実験を完全に代替するには至っておらず、さらなる発展が待たれている。今回開発した新規システムは、生体に類似した三次元構造と機能性(トランスポーターによる薬物取り込みなど)を保持しており、さらに1つの腎臓から複数のスライスを作成し、複数の実験条件を同時に試験することができることから、動物愛護の観点からも高いポテンシャルを持った実験系だと考えられる。
それぞれの部位でATP産生の仕組みが異なることが判明
この実験系を用いた結果、酸化的リン酸化の阻害剤の投与時には遠位尿細管ではATPがよく保たれるのに対し、近位尿細管では著明にATPが減少することが判明した。一方、解糖系の阻害剤の投与時には足細胞のATP低下が最も著明だった。このように、それぞれの部位でのATP産生の仕組みが異なることを明らかにした。
スライス培養系が動物内の代謝変化を反映していることを、シスプラチン投与で確認
続いて、腎障害時にどの部位がどのようにATP変動を起こすのかを観察した。虚血再灌流モデルを模倣した系においては、虚血を起こすと近位尿細管と遠位尿細管のATPが速やかに低下し、その後、再灌流後、近位尿細管のATP回復は、遠位尿細管と比較して不良であることが判明。さらには虚血時間が長くなるほど再灌流後の近位尿細管のATPの回復は不良であることがわかった。
これらの現象は動物実験でも同様の所見が観察されており、このスライス培養系が動物内の代謝変化を反映していることがわかる。また抗がん剤であるシスプラチンは副作用として腎障害を引き起こすことが知られているが、この培養系にシスプラチンを投与すると、濃度依存的に、近位尿細管と遠位尿細管でATP低下を認め、他の領域でのATP低下は軽微に留まることが明らかになった。
エネルギー代謝という観点からの腎臓病原因解明や、新規薬剤開発に役立つ可能性
研究グループは開発した新しいATP可視化技術を用いて、虚血再灌流モデルやシスプラチン腎症モデルだけでなく、さまざまな腎障害モデルでATP動態の観察・解析を進める予定だとしている。
「今回の実験では、腎臓スライスを作成した後に培養下でさまざまな障害を与えたが、マウスに障害モデルを惹起した後に腎臓のスライス切片を作成することで、エネルギー動態を解析することも可能だ。従来からあるメタボローム解析や質量分析イメージングといった代謝解析方法と本研究のATP可視化技術とが相互補完することで、腎臓病の創薬開発おいて今後、重要なツールとなることが期待される」と、研究グループは述べている。
▼関連リンク
・京都大学 最新の研究成果を知る



