心拍フィードバック、神経基盤の理解のためには動物モデルが必要
東京大学は6月21日、バイオフィードバック訓練を積むことで自分の心拍数を下げられるようになることを実証し、脳から心臓に司令が送られる仕組みを解明したと発表した。この研究は、同大大学院薬学系研究科の吉本愛梨大学院生、池谷裕二教授らの研究グループによるもの。研究成果は、「Science」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
自律神経系は不随意運動を制御し、内臓や血管など、個人の意思とは独立に働く器官を支配している。すなわち、自律神経系の支配を強く受ける心拍、血圧、体温、筋緊張といった生理活動およびその変化を、自身が感じ取ったり、意志で制御したりすることは通常不可能だ。しかし近年、心電図や脳波などの生体信号を測定し、その変動を被験者自身が認識できるよう呈示することにより、不随意性の生理活動を意識的に制御することが可能であることがわかってきた。この技術は「バイオフィードバック」と呼ばれている。
バイオフィードバックは多くの分野で応用され、病態の治療や健康増進の面で有用であるとされている。心拍については、訓練を重ねることで目標の心拍数まで下げることが可能だ。この技術を「心拍フィードバック」と呼ぶ。心拍はさまざまな心身状態とも関連するため、心拍フィードバックは循環器機能の改善はもちろん、疼痛や精神状態の改善や心身症の防止につながることが知られている。一方、脳内でどのような変化が起こって心身相関が達成されるのかが解明されておらず、神経基盤の理解のためには動物モデルが必要だ。しかし、言語を用いない動物に自己統制感を獲得させることは難しく、覚醒下の実験動物を用いた実験系は確立していなかった。
心拍フィードバックの実験系を構築、自由行動中のラットで
今回、研究グループは、自由行動中のラット用いて心拍フィードバックの実験系を初めて構築し、心拍フィードバックを可能とするメカニズムの解明に挑戦した。自由行動下ラットにおける心拍フィードバック系を確立した心拍数を下げるためのフィードバック訓練の具体的なパラダイムは下記の5ステップからなる。
(I)ラットの大胸筋に記録電極を留置し、さらに、左右のバレル皮質(ヒゲの感覚に対応している)と内側前脳束(報酬系の一部)に刺激電極を留置する。手術から十分回復させた後、以降の訓練を行う。
(II)自由行動下で心電図から心拍数を抽出し、目標心拍数を設定する。
(III)(II)で決めた目標心拍数に近づけば近づくほど、高頻度の電気刺激を左のバレル皮質に与える。これにより、ラットは現在の心拍数が目標心拍数に近いのかを知ることができる。
(IV)ラットが心拍数を目標心拍数まで下げたら内側前脳束を刺激し、報酬を与える。これによりラットは快楽を得られ、訓練が促進されると考えた。
(V)報酬刺激を10回得られたらより目標心拍数が低く設定される次のセッションに移行し、(III)と(IV)を繰り返す。
この訓練により、ラットの心拍数は平静時の毎分450回から、毎分200回程度まで下がることがわかった。すなわち、ラットにおける心拍フィードバック系を確立することに成功した。
ラットでの不安軽減・赤血球増加を確認
心身状態への影響を評価するために、不安症状に着目し、行動試験を実施。高架式十字迷路は、高所で壁がない危険なオープンアームと、壁のある安全なクローズドアームを含む迷路だ。各アームに滞在した時間の比から不安の程度を評価でき、クローズドアームにいる時間が長いほど不安が強いことを意味する。検討の結果、心拍フィードバックを5日間行った後では、訓練を開始する前に比較してオープンアームへの探索が増えた。総行動量は変化せずに、オープンアームの探索が増えた結果は、ラットが何らかの方法で不安や恐怖を抑制していることを示唆している。さらに、訓練後の高架式十字迷路試験では、訓練前に比較してオープンアームにおける心拍数が有意に低下していた。心拍フィードバックにより、不安が大きくなるオープンアームにおいても心拍数を低く維持することができるようになった結果、末梢シグナルである心拍数の情報が脳に影響を与え、不安に打ち勝つことができたと研究グループは考えている。また、血液循環機能の低下を代償するように赤血球が増えた。
前帯状皮質の神経細胞がシータ波を生み出し、心拍フィードバックによる心拍数の低下へ
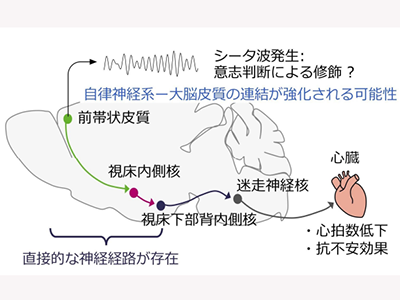
神経活動に応じて発現するタンパク質c-Fosに対する免疫組織化学染色により、心拍フィードバックにより活性化した脳領域を探索した。前帯状皮質や島皮質をはじめとする複数の脳領域が活性化している(c-Fos陽性になる)ことがわかった。GABAA受容体作動薬ムシモールを投与してこれらの領域の神経活動をそれぞれ抑制した。その結果、前帯状皮質を抑制したときに心拍フィードバックによる心拍数の減少が阻害された。さらに、前帯状皮質からの神経接続を持つ神経細胞を同定したところ、前帯状皮質の心拍フィードバック中に活動した細胞の多くが、視床内側核へと神経投射していることが見出された。
そこで、TetToxLc(テタヌス毒素軽鎖)を用いて視床内側核へ投射する前帯状皮質の神経細胞を抑制した。その結果、心拍フィードバックによる心拍減少の効果が減弱した。これらの結果から、前帯状皮質から視床内側核への入力が、心拍数の自己制御に必要であると考えられる。視床内側核へ投射を持つ前帯状皮質の細胞から神経活動を記録すると、心拍低下が進む訓練後期になるほどシータ波(7Hzの神経振動)の強度の有意な増加が見られた。このシータ波が徐脈の誘導の原因になっているかを調べるために、視床内側核に投射する前帯状皮質の神経細胞を光遺伝学的操作により7Hzのリズムで刺激することで、シータ波を人工的に誘導した。その結果、心拍フィードバックを行っていなくても、心拍数が低下することがわかった。つまり、視床内側核に投射を持つ前帯状皮質の神経細胞がシータ波を生み出すことで、心拍フィードバックによる心拍数の低下を引き起こしていると考えられる。
前帯状皮質-視床内側核回路、視床下部を介して副交感神経制御系に統合
心臓への副交感神経の支配は、脳幹に存在する迷走神経核が行っている。しかし、一般的な不随意性の制御ではなく、今回の実験で見られたような意志による心拍の制御においても、迷走神経核のニューロンが関与するのかは不明だった。迷走神経核への神経投射をもつ上流の脳領域を探索すると、視床下部背内側核がこれに該当することがわかった。
以上の結果から、前帯状皮質で生じた「意志」命令を、視床/視床下部を介して副交感神経系の中枢である迷走神経核に伝えると考えられる。すなわち、本来は結合性の弱く、意図的には制御できない自律神経系が、心拍数のフィードバックを受けることで、大脳皮質によって制御が可能となり、両者の連結が強化される可能性がある。
循環器・精神疾患治療など新たな治療法開発へ寄与の可能性
今回の研究では、意志による心拍数コントロールを可能とする神経回路を明らかにし、心拍フィードバック技術の神経学的基盤を解明した。この発見は、循環器疾患や精神疾患の治療、ストレス管理に応用可能で、心拍フィードバックの効果を最大化するための技術改良や、特定の神経回路をターゲットとした新たな治療法の開発に寄与する可能性がある。特に、心拍数の自己調節能力を向上させることで、不安の軽減、メンタルヘルスの向上、アスリートのパフォーマンス向上などが期待される。多くの生理活動が自律神経系により支配されていることを踏まえると、今回の発見は、心拍のみならず、呼吸や蠕動運動などの生理活動の自己制御にも拡張できると考えられる。同研究で明らかになった皮質-視床回路が、心拍以外の自律神経系制御にも汎化できるか検討することで、バイオフィードバックを担う神経基盤を精査し、脳と身体がどのように関係しているかという「脳身連関」の謎へ、新たな示唆を与えることができる、と研究グループは述べている。
▼関連リンク
・東京大学 プレスリリース



