先行研究より、慢性骨髄性白血病の治療薬ボスチニブに強い抗ALS病態効果
京都大学iPS細胞研究所(CiRA)は6月12日、「筋萎縮性側索硬化症(ALS)患者を対象としたボスチニブ第2相試験」(iDReAM試験:iPSC-based Drug Repurposing for ALS Medicine Study)を行い、ボスチニブの有効性と安全性を評価したと発表した。この研究は、同大iPS細胞研究所(CiRA)の井上治久教授、徳島大学病院脳神経内科和泉唯信教授、藤田浩司講師、京都大学医学部附属病院脳神経内科の髙橋良輔前教授、江川斉宏前院内講師、北里大学病院脳神経内科の西山和利教授、永井真貴子診療准教授、鳥取大学医学部附属病院脳神経内科の花島律子教授、渡辺保裕准教授、奈良県立医科大学附属病院脳神経内科の杉江和馬教授、東邦大学医療センター大森病院脳神経内科の狩野修教授、広島大学病院脳神経内科の丸山博文教授、秋田大学大学院医学系研究科の髙橋直人教授ら、愛知医科大学の祖父江元学長、中央事務局の熱田直樹准教授らの研究グループによるもの。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
筋萎縮性側索硬化症(ALS)は、運動神経細胞が変性して筋萎縮と筋力低下を来す進行性の疾患。経過に個人差はあるものの、人工呼吸器を使用されなければ、発症から数年で落命する疾患。ALSの進行を緩和する既存薬はあるが、いまだALSの進行を停止する根本的治療は確立されていない。
これまで、研究グループは、ALS患者由来のiPS細胞から作製した運動神経細胞を用いて、ALSの病態を再現できることを見出し、さらに、ALSの病態の中核である運動神経細胞の細胞死と異常タンパク質の蓄積を抑えることができる化合物のスクリーニングを行うiMNシステムを構築した。このシステムを用いて、すでに他の疾患で治療薬として用いられている物質を含むさまざまな種類の化合物をスクリーニング。その結果、強い抗ALS病態効果を有するボスチニブを同定したことを報告した。ボスチニブ(販売名:ボシュリフ(R)錠)は、慢性骨髄性白血病の治療薬として製造販売承認されている薬剤。ALSはボスチニブの適応症として日本および世界各国で承認されておらず、ALSに対する有効性、安全性および用法用量は確立されていない。そのため、ボスチニブは現時点でALSの治療薬として使用できる状況にない。
P1試験、ALS患者へのボスチニブの安全性と忍容性確認
研究グループは、2019~2021年まで、「筋萎縮性側索硬化症(ALS)患者を対象としたボスチニブ第1相試験(iDReAM試験)」を行い、ALS患者におけるボスチニブの安全性と忍容性を評価し、探索的に有効性評価を行った。その結果、参加された患者の人数に限りはあるものの、ボスチニブにALS特有の有害事象は認められなかったこと、ボスチニブの投与期間に一部の患者でALSの進行の抑制が認められたこと、その目印となる可能性のある指標があったことを見出した。
P2試験、ALS患者自然歴のデータと比較検証
2022年から第2相試験として、約25人のALS患者において、ボスチニブの24週間投与時の有効性および安全性を評価することを目的とした多施設共同の非盲検試験を開始した。近年、プラセボと呼ばれる偽薬を対照とした比較試験の実施の代わりに、実際の医療環境下で取得されたリアルワールドデータを外部対照として活用することが進められつつある。同試験では、対照としてプラセボは用いず、過去のALS試験の結果に基づき有効性に関する基準を事前に設定するとともに、探索的に多施設共同ALS患者のレジストリ(JaCALS)に登録されている患者の自然歴のデータとの比較を行った。
運動機能障害の強さを示すALSFRS-Rのスコア低下を抑制
ALS患者26人が試験に参加され、ボスチニブ1日量200mgもしくは300mgを投与された。主要評価項目では、ALSの承認薬であるエダラボンの臨床試験(MCI186-19)のプラセボ群に基づく基準に比べて、運動機能障害の強さを示すALSFRS-Rのスコアの低下が抑制されていることが示された。副次評価項目では、有効性に関して事前に定めた基準を達成した項目と達成に至らなかった項目があった。安全性評価では、ALS特有の有害事象はなかったが、下痢、肝機能障害などが認められた。これらの有害事象は、治験実施計画書に規定した基準に基づき、ボスチニブの用法用量の調整や支持療法による管理が必要な場合があった。
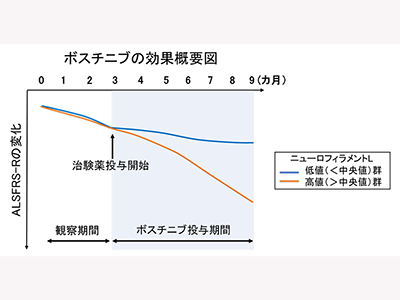
探索的評価として実施したJaCALSデータとの比較において、ボスチニブの有効性が示唆された。また、ALSのバイオマーカーである血漿中ニューロフィラメントL(NFL)値は、発症後は平均すると一定の値で推移することが過去のレビュー論文で報告されている。同治験においては、血漿中NFLの値を観察期間(ボスチニブ投与開始前)と治験薬投与期間で測定したところ、治験薬投与後、患者のNFLの平均値が治験薬投与前の平均値よりも低下していた。しかし、観察期間にNFLの自然低下を示した患者もいたことから、このNFLの値の推移については今後の解析により慎重に検討するとしている。さらに、ボスチニブの24週間の投与において、探索的に行った評価において、第1相試験の結果と同様に以下のように一部の患者でALSの進行の抑制が認められる結果が得られた。
今後第1相試験・第2相試験の結果に基づいて、次の計画を検討していく、と研究グループは述べている。
▼関連リンク
・京都大学iPS細胞研究所(CiRA) プレスリリース



