遠位型ミオパチーの一種、日本の患者数推定400名の指定難病
東北大学は6月10日、2010年から医師主導治験として第1相試験、第2/3相試験、ノーベルファーマ株式会社が治験依頼者となる有効性確認試験を実施し、縁取り空胞を伴う遠位型ミオパチー(GNEミオパチー)を対象としたアセノベル(R)徐放錠500mg(一般名:アセノイラミン酸)の治療効果を明らかにしたと発表した。この研究は、同大大学院医学系研究科神経内科学分野の青木正志教授ら、国立精神・神経医療研究センター、名古屋大学、大阪大学、国際医療福祉大学の研究グループによるもの。研究成果は、「Journal of Neurology, Neurosurgery, and Psychiatry」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
遠位型ミオパチーの一種であるGNEミオパチーは、体幹から離れた部位から筋肉が萎縮、変性し次第に体の自由が奪われていく有効な治療法のない希少疾病であり、指定難病。日本の患者数は400名程度と推定され、その多くが10代後半~30代にかけて発症している。
同疾患は1980年代に埜中ら・水澤らにより世界に先駆けて臨床病型が報告された。2001年に、その原因遺伝子GNEから合成されるタンパク質がシアル酸代謝に関わる酵素であることが見出され、国立精神・神経医療研究センター神経研究所疾病研究第一部、西野一三部長らによりモデルマウスにてシアル酸補充療法の予防効果が示された。
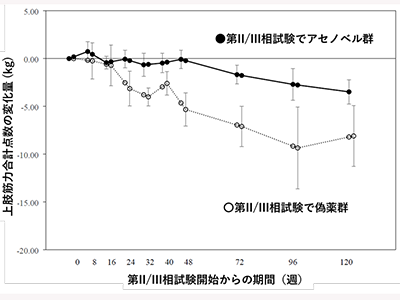
P2/3試験、アセノベル群で上肢筋力合計点数の低下を長期間にわたり軽減
これを受けて青木正志教授らのグループは、2010~2011年に、世界で初めて医師主導治験として第1相試験を実施。その後、医師主導第1相試験(追加)を行い、シアル酸の一種であるアセノイラミン酸のファースト・イン・ヒューマンの検討を通して、安全性を確立した。
次いで、日本医療研究開発機構の難治性疾患実用化研究事業として実施した医師主導第2/3相試験、ノーベルファーマ株式会社が治験依頼者となる有効性確認試験を実施しGNEミオパチーにおけるアセノイラミン酸の効果を明らかにした。第2/3相試験のアセノベル投与群では上肢筋力合計点数の低下を長期間にわたり軽減することが明らかとなった。
3月に承認、世界初・ウルトラオーファンへの治療開発の成功例
これらの結果をもとにノーベルファーマ株式会社が薬事承認申請を行い、2024年2月29日に厚生労働省医薬品第一部会において製造販売承認が了承され、同年3月26日に正式な製造販売承認を取得。開発がきわめて困難といわれているウルトラオーファンの疾患GNEミオパチーに対する治療開発の世界初の成功例となり、世界に先駆けた成果として注目されている。
P2/3試験終了患者19例に72週間継続投与、安全性と有効性を確認
今回の研究では医師主導第2/3相試験48週の二重盲検期を終えた19例の患者に対して、72週間にわたってアセノベル徐放錠を継続投与し、安全性と有効性を確認。今後は製造販売後調査によりリアルワールドでの効果を検証していくことが大事となる。そのため、研究グループ長期投与での安全性が担保されていることは重要な知見であると考えるとしている。今回の結果によりGNEミオパチー患者への長期投与の安全性が担保された、と研究グループは述べている。
▼関連リンク
・東北大学 プレスリリース



