ゲノム構造変化させる二次的変異、SHH型髄芽腫の悪性転換を促進するとわかってきた
国立精神・神経医療研究センター(NCNP)は6月4日、代表的な小児悪性脳腫瘍の一つである「髄芽腫」において、起源細胞とがんの間でゲノム構造の変化を比較することで、髄芽腫がん遺伝子の発現を制御する新たな分子NFIBを同定し、この分子を薬理的に阻害することで腫瘍の増殖を効果的に抑制できることを示したと発表した。この研究は、NCNP神経研究所病態生化学研究部の川内大輔室長(現 名古屋市立大学大学院医学研究科脳神経科学研究所教授)、フランスキュリー研究所のOlivier Ayrault博士、がん研究会がん研究所の丸山玲緒プロジェクトリーダーらの研究グループによるもの。研究成果は、「Developmental Cell」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
髄芽腫は代表的な小児悪性脳腫瘍であり、最も多角的にがんの詳細な解析(オミクス解析)が進んでいる。この腫瘍は大きく4つの亜群に分類され、その中のソニックヘッジホッグ(SHH)型髄芽腫は全髄芽腫の約30%を占める。この腫瘍の起源細胞である小脳顆粒細胞前駆体(GNP)の増殖はSHHシグナルにより刺激されるが、遺伝子変異によるこのシグナルの異常な活性化により、腫瘍形成が開始されることがわかってきている。しかしながら、近年の研究からSHHシグナルに加え、新たな二次的変異ががんの悪性転換を促進することが知られ、ゲノム構造に変化をもたらす因子(クロマチン制御因子)群に多くの変異が発見されている。このことから、がん特有のゲノム構造を作り出すことががんの進展に重要であり、それを壊すアプローチがより広い亜群を対象とした新たな治療戦略となりうることが考えられる。しかし、これまでに髄芽腫特有のゲノム構造を作り出す機構はほぼ知られていない。このため、がんのエピゲノム形成機構を基盤とした治療標的の探索が期待されている。
腫瘍細胞形成・進展に関与するタンパク質としてNFIファミリーを同定
SHH型髄芽腫はPtch1遺伝子の欠損によってトリガーされることが知られている。そこで研究グループは、マウス個体の小脳表層に存在する小脳顆粒細胞に対して、電気穿孔法によりsgPtch1とspCas9遺伝子を導入してPtch1遺伝子をノックアウトし、腫瘍を誘導する系を確立した。特にこの系で腫瘍の進展を時間経過とともに観察しやすくするためにAtoh1EGFPマウスを利用して、変異細胞をEGFPで遺伝学的に標識し、生後7日目、生後28日目、成獣マウスの時期に、それぞれEGFP陽性のGNP、前がん病変(Preneoplastic cell:PNC)およびがん細胞をFACSにより回収した。
これらの細胞のオープンクロマチン状態を解析したところ、PNCおよびがん細胞でクロマチンが開いている領域にはNFIファミリータンパク質の結合ドメインが有意に多く存在していることがわかった。この結果から「NFIファミリー分子が髄芽腫の形成過程で重要な役割を担っている」との仮説を立て、sgPtch1とspCas9遺伝子に加え、sgNfiaやsgNfibを同時に遺伝子導入してノックアウトした結果、前がん形成が阻害されることが明らかになった。さらに、マウス髄芽腫細胞において短ヘアピンRNAによりNfiaあるいはNfib遺伝子の発現を阻害すると、腫瘍を移植された免疫不全マウスの寿命が伸びることが明らかになった。以上のことから、NFIファミリータンパク質がSHH型髄芽腫の腫瘍形成の初期過程だけでなく腫瘍進展にも重要であることがわかった。
NFIファミリー転写因子、がん遺伝子のオープンクロマチン領域に結合し発現を促進
次に、GNP、PNCおよびがん細胞におけるNFIA、NFIBの実際の結合部位を解析し、PNCおよびがん細胞でNFIA、NFIBが結合している領域と、クロマチンが開いている領域とが有意に重なることを明らかにした。これらの領域は、Sox1やAtoh1といったがん遺伝子のプロモータ領域を含んでおり、NFIファミリー因子ががん遺伝子を調節している可能性が示唆された。さらに、GNP、PNCおよびがん細胞のシングルセル解析を行い、各遺伝子とそれぞれの遺伝子発現を調節する制御領域を明らかにした。その結果、PNCおよびがん細胞でクロマチンが開き、かつNFIファミリー転写因子が結合しているゲノム領域は、細胞周期に関連する遺伝子の発現制御領域であることがわかった。以上から、NFIファミリー転写因子が、がんゲノムに特徴的な領域に結合することで、がん遺伝子の発現を促進していることがわかった。
shRNAによるNFIファミリータンパク質阻害でヒト髄芽腫モデルのエピゲノム変化
続いて、研究グループはマウスモデルで観察されたNFIファミリータンパク質のshRNAノックダウンによる抗腫瘍効果がヒト腫瘍でも観察されるかどうかを検証した。ヒト腫瘍モデルとして、SHH型髄芽腫の患者由来腫瘍移植(PDX)モデルを用いた。マウスの場合と同様にヒト腫瘍でもNFIファミリータンパク質をshRNAで阻害すると、特にNFIBで顕著にクロマチンの開閉状態が変化した。このことからNFIBががんのエピゲノム維持に大きく関わっていることが示唆される。また、ヒト細胞の場合もNFIファミリータンパク質のshRNAノックダウン後に免疫不全マウスに移植すると、腫瘍進展が阻害された。以上の観察から、NFIファミリータンパク質がSHH型髄芽腫の治療標的となりうることが示唆された。
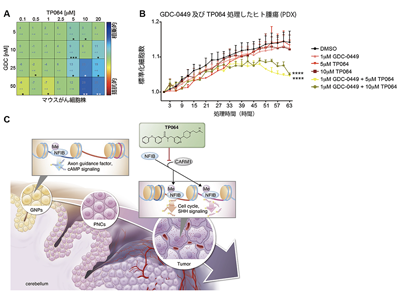
NFIB機能を抑制するTP064、SHH阻害剤と併用で抗腫瘍効果を発揮
最後に研究グループはNFIファミリータンパク質を薬理的に阻害して抗腫瘍効果を引き起こせる可能性を検証した。最新の研究で、NFIBの388番目のアルギニン残基のメチル化がNFIBの機能に必須であることが報告されていることから、アルギニン残基のメチル化酵素CARM1の阻害剤であるTP064の抗腫瘍効果を解析した。その結果、マウスの腫瘍モデルでSHH阻害剤と組み合わせた際に相乗効果による強力な抗腫瘍効果が確認された。また、興味深いことに、単独ではSHH阻害剤とTP064に対して抵抗性を示すヒトのSHH型髄芽腫も、これらを併用することで抗腫瘍効果が得られることが明らかになった。これらの結果から、エピジェネティック薬と分子標的薬の併用療法の有効性が示され、エピゲノムの理解から導かれた新しい治療戦略が開発されることが期待される。
エピゲノム理解による遺伝子変異以外の治療標的同定、さまざまながん種で応用可能
今回の研究では、SHH型髄芽腫における新しい治療標的候補分子としてNFIファミリーを報告した。また、同時にエピゲノムの理解により、遺伝子変異によらないがんに重要な治療標的の同定に成功したマイルストーンとなる研究といえる。「この研究アプローチは、SHH型髄芽腫だけではなく、異なるタイプのがんに対しても有効なため、今後、さまざまながん種で新しい治療標的の同定が加速することが期待される」と、研究グループは述べている。
▼関連リンク
・国立精神・神経医療研究センター プレスリリース




