従来の胎盤細胞培養モデルに課題
東京医科歯科大学は2月8日、ヒトの胎盤幹細胞を用いて、生体内の絨毛に類似した胎盤オルガノイドを作製し、母体-胎児間で起きる物質移行を評価することを可能とする胎盤バリアモデル(厚みを持った胎盤細胞シート)の開発に成功したと発表した。この研究は、同大生体材料工学研究所 診断治療システム医工学分野の梶弘和教授、堀武志助教、東北大学大学院医学系研究科情報遺伝学分野の有馬隆博名誉教授、柴田峻助教、小林枝里助教、熊本大学発生医学研究所胎盤発生分野の岡江寛明教授らの研究グループによるもの。研究成果は、「Nature Communications」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
ヒトの胎盤は、妊娠の維持に必要なホルモンの産生を行うだけでなく、医薬品やウイルス等の異物から胎児を守る関門(バリア)としての役割も担っている。しかし、一部の医薬品やウイルスは、胎盤を透過し、胎児に影響を及ぼすことが知られている。胎児へのリスクを最小限に抑えた医薬品を開発するために、創薬では物質の胎盤透過性や胎児への移行量を正確に推定することが重要だ。胎盤の構造や胎盤を構成する細胞には大きな種差が存在するため、動物実験から得られた物質胎盤透過性情報をヒトに外挿することが難しいことが知られている。また、これまでに開発されてきたほとんどの胎盤細胞培養モデルは、生体内の胎盤細胞とは異なる機能を持った絨毛がん由来の細胞が使用されてきたため、ヒトの胎盤についての正確な情報が十分に得られていなかった。
長期間未分化を維持でき、多能性を有する「ヒトTS細胞」の活用で克服へ
一方、東北大学医学系研究科では、ヒト胎盤幹(TS)細胞を樹立することに成功していた。この細胞は、安定に長期間未分化を維持でき(80継代以上)、また、ホルモン分泌に働く合胞体性栄養膜(ST)細胞や浸潤能を有する絨毛外性栄養膜(EVT)細胞へと分化する多能性を有している。そこで、ヒトTS細胞を活用し、東京医科歯科大学の研究グループと共同で細胞組織工学技術を駆使した、ヒトの胎盤を模倣した新規のヒト胎盤バリアモデルの開発に取り組んだ。
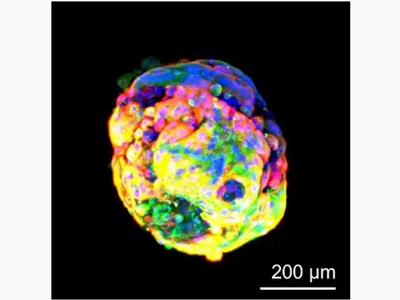
胎盤幹細胞を立体的に培養し絨毛構造を模倣、胎盤バリアモデル開発も成功
ヒトの胎盤の中には絨毛があり、妊娠初期の絨毛の表面は合胞体性栄養膜細胞(以下、バリア細胞)と細胞性栄養膜細胞から成る2層構造をしている。研究では、ヒトの胎盤から樹立された胎盤幹細胞を3次元的(立体的)に培養することにより、この絨毛表面の構造を作り出すことを試みた。胎盤形成に関わる成長因子などを培養液に添加した後、8日間ほど培養した結果、球状の胎盤オルガノイドを作製することに成功した。この胎盤オルガノイドを詳細に解析した結果、実際の絨毛と同様に表面の細胞は融合しており、また、多くの微絨毛が観察された。
さらに、この胎盤オルガノイドの培養条件をもとに、母体-胎児間で起きる物質移行を評価することを可能とする胎盤バリアモデル(厚みを持った胎盤細胞シート)の開発に成功した。
胎児への副作用の小さい新薬開発への貢献が期待される成果
研究により、ヒト胎盤オルガノイドと胎盤バリアモデルを作製する方法が明らかになり、この成果は、ヒトの胎盤研究を加速させるものと考えられる。例えば、ウイルス等の病原体や環境化学物質、医薬品などの胎盤に対する影響が明らかになれば、より適切な医療や環境対策につなげられるものと考えられる。さらに、医薬品候補化合物の胎盤透過性を評価することにより、胎児への副作用の小さい新薬の開発につなげられるものと考えられる。「ヒト胎盤モデルの作製は、ヒト胎盤の形成メカニズムや胎盤に関連した疾患(妊娠高血圧症候群等)の解明にも貢献するものと考えられる」と、研究グループは述べている。
▼関連リンク
・東京医科歯科大学 プレスリリース




