SARS-CoV-2感染による血管構造・機能への影響、生体外での再現は困難だった
京都大学は1月24日、三次元的な構造を持った気管支と血管の組織を再現できる生体模倣システム(Microphysiological systems:MPS)を開発し、新型コロナウイルスへの感染によって放出されるインターフェロン分子が血管の構造に影響を与えることを見出したと発表した。この研究は、同大大学院工学研究科の横川隆司教授、藤本和也助教、iPS細胞研究所の高山和雄講師、医学研究科の長尾美紀教授、順天堂大学の岡本徹教授らの研究グループによるもの。研究成果は、「Lab on a Chip」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
COVID-19はコロナウイルスの一種である新型コロナウイルス(SARS-CoV-2)が感染することで起こり、呼吸器での症状をはじめとして多様な症状を引き起こす。特に、血管での炎症など血管に関連した症状が多く報告されており、血管の構造や機能の障害が重症化と相関するという研究結果も報告されている。血管が傷害される原因として、ウイルスが血管内皮細胞に直接感染することや、ウイルス感染に対する免疫反応が過剰に働くことなどが想定されているが、このような複数の器官同士の相互作用を生体外で再現することは困難だった。
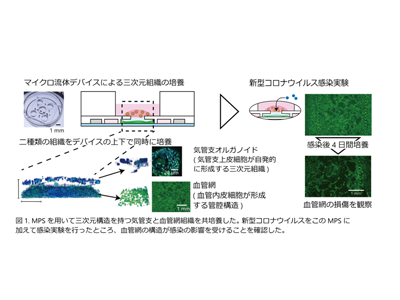
マイクロ流体デバイスによる生体模倣システムに着目、気管支と血管網の三次元共培養系を構築
近年、マイクロ流体デバイスを利用して生体機能を再現する、MPSの研究開発が目覚しい発展を遂げている。新型コロナウイルスの感染が呼吸器・血管に与える影響についてもMPSを用いた研究が報告されているが、多孔質膜の上下で呼吸器細胞と血管内皮細胞を共培養する二次元的な細胞配置であり、三次元的な構造が実現できていない。
研究グループは、多層構造のマイクロ流体デバイス内で血管床を作製し、その上で気管支オルガノイドを培養する手法を確立した。この細胞配置により、気管支上皮細胞と血管内皮細胞に選択的にSARS-CoV-2を導入することができ、それぞれの器官における感染ともう一方の器官への影響を評価することができるようになった。
感染4日目に血管構造損傷しウイルスが血管網へ拡散、細胞骨格乱れ血管同士の接続喪失
その結果、気管支上皮細胞からはウイルスが検出されたのに対して、血管内皮細胞への感染は低いレベルにとどまった。また、ウイルスを加えてから3日目まで血管網の培養液からは検出されなかったウイルスのmRNAが、4日目から検出されるようになった。これは、4日目に血管の構造が損傷し、気管支上皮細胞で増殖したウイルスが血管網の培地まで拡散して移動したためと考えられる。また、感染した細胞での遺伝子発現を網羅的に計測した結果から、感染細胞で自然免疫応答に関連する遺伝子の発現量増加を多く確認した。感染実験後、血管網の構造が縮み血管同士の接続が失われていることがわかった。さらに、血管網を構成する内皮細胞が失われ、正常な血管では揃っている細胞骨格の秩序も乱れていることがわかった。
I型インターフェロン阻害剤、血管網構造への影響を抑制
得られた実験結果から、感染した気管支上皮細胞からのI型インターフェロンに関連する分子の分泌が血管網の損傷を引き起こしていると考え、その阻害剤を加えて感染実験を行った。その結果、気管支上皮細胞への感染は依然として見られたものの、血管網構造への影響は抑制されることがわかった。
また、CRISPR-Cas9を用いてゲノム編集を行い、I型インターフェロンのひとつであるIFNB1遺伝子を欠損させた気管支上皮細胞と、インターフェロンの受容体であるIFNRA2遺伝子を欠損させた血管内皮細胞を用いて同様の実験を行ったところ、どちらも同じように血管への影響が抑制された。これらのことから、自然免疫応答において重要な役割を果たすI型インターフェロンが三次元的な血管構造の健全性に影響していることが示された。
今後の感染症研究に有効なアプローチとして期待できる
ウイルス感染症が人体におよぼす影響を一種類の培養細胞への感染実験で再現することは困難であり、生体外で複数の細胞からなる組織を共存させ、相互の影響を評価することが不可欠である。今回の研究で確立した三次元組織の共培養とウイルス感染実験およびその評価手法は、COVID-19の病態のさらなる理解や今後想定される新興再興感染症の研究に向けて有効なアプローチの一つとなることが期待できる。「今後は、免疫細胞も含んだモデルや、気管支以外の組織と血管系の三次元共培養モデルの開発を進める予定」と、研究グループは述べている。
▼関連リンク
・京都大学工学部・大学院工学研究科 最近の研究成果



