MTU1遺伝子変異と関連する可逆性小児急性肝障害、発症の仕組みは未解明
東北大学は12月27日、可逆性小児肝不全患者で報告されている17種類のMTU1遺伝子変異の作用を明らかにしたと発表した。この研究は、同大加齢医学研究所の魏范研教授、Raja Norazireen Raja Ahmad研究員、熊本大学大学院生命科学研究部の富澤一仁教授、筑波大学計算科学研究センターの重田育照教授らの研究グループによるもの。研究成果は、「Nucleic Acids Research」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
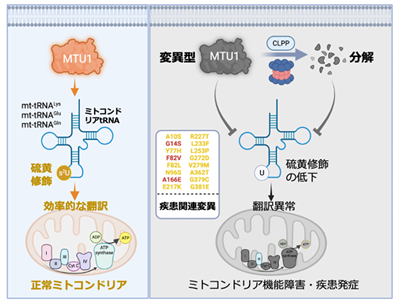
ミトコンドリアは細胞のエネルギー代謝を司る中心的な細胞小器官であり、独自のゲノムDNAを有する。ミトコンドリアDNAには22種類の移転RNA(tRNA)がコードされており、同じくミトコンドリアDNAから転写される13種類のmRNAをタンパク質に翻訳するために用いられている。ミトコンドリアtRNAの特徴として、さまざまな化学修飾が塩基に施されていることが挙げられる。ミトコンドリアtRNAのうち、3種類のtRNAに硫黄が付加されることが知られており、また、その修飾を媒介する酵素としてMTU1が同定されている。MTU1を欠損すると、ミトコンドリア内のタンパク質翻訳が停止し、その結果、エネルギー代謝に必要なタンパク質が作られなくなり、細胞機能が急激に低下する。MTU1を欠損したマウスは胚発生ができなくなることが示すように、MTU1によるミトコンドリアtRNAの硫黄修飾は生命の営みに不可欠である。
MTU1は可逆性小児急性肝障害の発症と関連している。この疾患は新生児期にごくまれに発症する希少疾患であり、世界で50数例報告されている。これらの患者は急激な肝機能障害、心不全、腎機能低下といった症状を呈し、死に至る症例も報告されている。一方、急性期の肝障害を乗り切ってその後症状が沈静化するケースも報告されている。なぜこのように症状に大きな違いがあるのかについてはわかっていない。
可逆性小児急性肝障害の患者において、MTU1遺伝子にさまざまな変異が存在することが知られており、疾患原因として考えられている。しかし、個々の遺伝子変異がMTU1によるミトコンドリアtRNAの硫黄修飾にどのように影響するのかついて詳細に調べられておらず、発症の分子機構が不明だった。また、発症の分子機構が解明されていないため、この疾患に対しては対症療法以外に治療法がなかった。
17種類の疾患関連変異を解析、MTU1による硫黄修飾レベルと患者の生存率に関連
今回の研究では、小児急性肝障害患者で見つかっている17種類の疾患関連変異がMTU1の硫黄修飾活性にどのように影響するかを調べた。まず正常細胞においてMTU1遺伝子の機能をなくし、その後、患者で見つかっている変異型MTU1を同細胞に導入した。17種類の変異型細胞を作製し、ミトコンドリアtRNAの硫黄修飾レベル、そして変異型MTU1のタンパク質量などを詳細に調べた結果、変異型MTU1を有する細胞では、正常細胞と比べて、MTU1によるミトコンドリアtRNAの硫黄修飾レベルが劇的に低下した。興味深いことに、多くのMTU1変異細胞については硫黄修飾がある程度残存しており、部分的機能障害型変異であることが示された。重要なことに、各変異細胞における硫黄修飾の障害度と臨床所見との関連性を調べた結果、障害率によって患者の生存率が大きく異なることがわかった。正常と比べて硫黄修飾が90%以上障害される変異型MTU1を有する患者は生存率が非常に悪いのに対して、正常と比べて硫黄修飾が90%以下障害される変異型MTU1を有する患者は生存率が高いものだった。このように、患者に見られる生存率の差は、保有する変異MTU1の残存硫黄修飾活性に大きく依存することがわかった。
MTU1変異細胞におけるプロテアーゼCLPPの抑制、ミトコンドリアtRNAの硫黄修飾量を亢進
一方、正常細胞と変異型MTU1を有する細胞におけるMTU1のタンパク質量を調べた結果、正常型MTU1と比べて、変異型MTU1タンパク質は素早く分解され、細胞での存在量が少ないことがわかった。MTU1がどのプロテアーゼによって分解されるかを調べるため、遺伝子ノックダウンや免疫沈降などの実験を行った。その結果、MTU1はCLPPと呼ばれるプロテアーゼによって分解されることがわかった。重要なことに、変異型MTU1を有する細胞においてCLPP遺伝子の発現を抑制した結果、変異型MTU1タンパク質量が増加し、さらにミトコンドリアtRNAの硫黄修飾量が顕著に亢進した。さらに、変異型MTU1はなぜCLPPによって分解されやすいかを調べるため、コンピューターを用いた構造シミュレーションを行った。その結果、変異型MTU1は正常型と比べてわずかに構造変化が生じていたことがわかった。
これらの結果から、変異型MTU1による疾患発症機構の一端が明らかになった。すなわち、疾患関連アミノ酸変異によりMTU1が少し変形した結果、CLPPによって分解されやすくなる。そして、変異型MTU1はまだ活性が残っているにもかかわらず、全体的にタンパク質量が低下するため、効率的にミトコンドリアtRNAに硫黄修飾を付加できなくなり、そしてミトコンドリアタンパク質翻訳とエネルギー代謝が低下し、最終的に疾患発症に至ると考えられた。さらにこの研究により、CLPPの抑制がMTU1の分解を阻止することで、タンパク質量と硫黄修飾量の回復につながることが示され、可逆性小児急性肝不全の治療に道筋をつける結果となった。
今回の研究で、MTU1病原性変異の意義と分子機序を明らかにしたことで、難病治療に新しい方向性を示すことができた。まず、多数の変異型MTU1の機能解析と疾患との関連を調べ、重症化しやすい変異を同定したことで、変異の種類に応じて症状が激化する前から肝機能の保全といった介入が可能になり、重症化の阻止と治療効果の最大化が期待される。「本研究によりCLPP阻害が硫黄修飾の回復につながることが示されたことから、将来的にCLPP阻害剤を開発できれば、小児急性肝不全という難病の治療薬を創出することが可能になる」と、研究グループは述べている。
▼関連リンク
・東北大学 プレスリリース・研究成果




