AK2遺伝子変異で惹起される免疫不全症、好中球成熟障害が予後や移植の成否に影響
京都大学iPS細胞研究所(CiRA)は12月1日、iPS細胞モデルを用い、ミトコンドリアピルビン酸キャリアの阻害剤が細網異形成症に見られる好中球成熟障害を改善する可能性を示したと発表した。この研究は、同センター臨床応用研究部門のWang Jingxin研究員(研究当時)、齋藤潤教授、東京医科歯科大学統合研究機構、熊本県立大学環境共生学部、島根県立大学看護栄養学部、広島女学院大学人間生活学部、実験動物中央研究所らの研究グループによるもの。研究成果は、「Biochemical and Biophysical Research Communications」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
細網異形成症は、アデニル酸キナーゼ2(AK2)遺伝子の機能喪失変異によって引き起こされるまれな遺伝性疾患である。細網異形成症患者は重篤な複合免疫不全に苦しみ、早期の造血幹細胞移植を受けなければ、幼少期に感染症で死亡する。細網異形成症の免疫不全の特徴は、リンパ球減少のほか、特有の好中球成熟障害による好中球減少症がみられることである。好中球減少症は細菌感染症のリスクを高めるため、患者の生命予後や造血幹細胞移植の成否に影響する。研究グループは、細網異形成症の好中球減少症を改善する化合物の探索を目指した。
患者由来iPS細胞から作製した造血前駆細胞、ミトコンドリアにATPが貯留し核のATP枯渇
細網異形成症ではAK2の機能不全によるミトコンドリアの代謝障害が原因となり、造血前駆細胞の機能障害を引き起こす。以前研究グループは、細網異形成症患者由来iPS細胞から作製した造血前駆細胞はミトコンドリアに細胞内エネルギーであるアデノシン3リン酸(ATP)が貯留し、核へのATP供給が枯渇することを報告した。
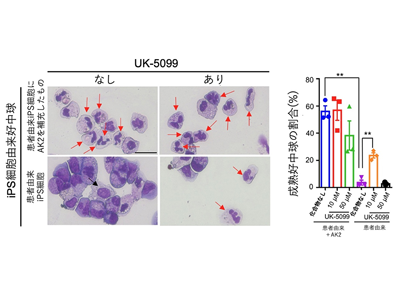
ミトコンドリアピルビン酸キャリア阻害剤UK-5099、10μM添加で患者由来好中球の成熟改善
今回、この結果を踏まえ、ミトコンドリアピルビン酸キャリア(MPC)の阻害剤であるUK-5099を用いて、細胞内のエネルギー分布を変更し、造血前駆細胞の好中球分化能力に影響を与えることを試みた。MPCはミトコンドリアでATPを産生するために、解糖系の産物であるピルビン酸を細胞質からミトコンドリアに移送するタンパク質である。研究グループは、MPCの機能を阻害することによって、ミトコンドリアでのATP産生を抑制し、嫌気的条件でのATP産生を亢進させることができると考えた。
細網異形成症由来のiPS細胞からの好中球の成熟は、UK-5099の添加によって改善された。特に、10μMのUK-5099を治療に用いた際、成熟好中球の割合が有意に増加した。しかし、50μMのより高濃度のUK-5099では、成熟好中球の数が減少することが確認された。
UK-5099、AK2欠損PSC株でも好中球成熟の改善を確認
より正確に好中球分化とUK-5099の効果を評価するため、野生型多能性幹細胞のAK2遺伝子を欠損させた多能性幹細胞(PSC)株を作成した。これらのAK2欠損PSC株から分化させた好中球は、野生型PSC株に比べて好中球の成熟が著しく低下していることが確認された。また、UK-5099は野生型多能性幹細胞株の好中球成熟に影響を与えず、AK2欠損株でのみ好中球成熟を改善した。
活性酸素種のレベルとは無関係に好中球成熟改善
細網異形成症患者由来iPS細胞の好中球成熟障害は活性酸素の増加と関連している可能性が報告されている。しかし、今回の研究ではUK-5099添加は血球前駆細胞の活性酸素種のレベルに影響を与えなかった。したがって、UK-5099添加による好中球の成熟改善が活性酸素種のレベルとは無関係であることが示唆された。
メカニズム解明やリンパ球欠損症状への評価が必要だが、有望な治療法につながる可能性
この研究は、細網異形成症の治療に向けた新たな方向性を示した。UK-5099とMPCは、細網異形成症における好中球成熟の欠陥に対する有望な治療標的としての可能性を秘めている。「さらなる研究により、UK-5099が代謝分布と分化プログラムをどのように連携させるのか、そのメカニズムの解明が必要である。また、リンパ球欠損という細網異形成症の重要な症状に対する効果も評価する必要がある」と、研究グループは述べている。
▼関連リンク
・京都大学iPS細胞研究所(CiRA) ニュース



