トリプルネガティブ乳がん、がん幹細胞のどのサブタイプが治療抵抗性を示すのか?
金沢大学は11月16日、乳がん再発の原因細胞の取り出しに成功したと発表した。この研究は、同大がん進展制御研究所/新学術創成研究機構の後藤典子教授、帝京大学先端総合研究機構の岡本康司教授、東京大学大学院新領域創成科学研究科の鈴木穣教授、定量生命科学研究所の中戸隆一郎准教授、大学院医学系研究科乳腺・内分泌外科学の田辺真彦准教授、京都大学大学院医学系研究科の小川誠司教授、東京医科歯科大学大学院医歯学総合研究科の浅原弘嗣教授、神奈川県立がんセンター臨床研究所の宮城洋平所長、佐藤慎哉医長らの研究グループによるもの。研究成果は、「Journal of Clinical Investigation」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
乳がんはいくつかのサブタイプに分かれている。女性ホルモン受容体や、細胞表面にある受容体HER2が陽性のサブタイプのがんに対しては、近年優れた分子標的薬が開発されており、患者の予後が改善されてきた。一方で、女性ホルモン受容体(エストロゲン受容体とプロゲステロン受容体)およびHER2の3受容体全てが陰性のトリプルネガティブタイプの乳がんに対しては、まだ治療効果が期待できる分子標的薬がない。
乳がん手術後に抗がん剤治療が必須となる症例を中心に、治療反応性を評価することを主目的として、手術前に抗がん剤や分子標的薬による全身治療を行う「術前全身治療」が、標準治療の一つとして行われている。しかし、手術後数年~十数年経って転移再発が顕在化して命が奪われる症例が一定数あり、乳がんによる死亡数増加の大きな原因になっている。世界中で研究が行われた結果、術前全身治療後の病理学的検査の際、乳腺組織内にがん細胞の遺残が認められた症例において、転移再発が顕在化する症例が多く、生命予後に影響を及ぼすことが報告されている。
近年、がん組織は、がん幹細胞が分化と増殖を繰り返して構築されると考えられつつある。いくつかの細胞膜タンパク質に対する抗体を用いた細胞ソーティングを行って、がん幹細胞を濃縮できることが報告され、世界中で研究が行われている。研究グループは、細胞膜タンパク質ニューロピリン1(NRP1)や、IGF1受容体(IGF1R)を用いて、トリプルネガティブ乳がんのがん幹細胞を濃縮できることをこれまでに報告してきた。また、がん幹細胞は、治療に対して抵抗性を示すこともわかってきている。しかし、がん幹細胞集団を構成するどの細胞が治療抵抗性なのか不明だった。
1細胞解析でがん幹細胞を5集団に分類、トリネガ乳がん発生細胞様の「祖先がん幹細胞」を発見
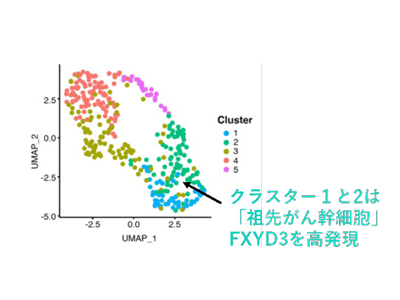
今回の研究では、トリプルネガティブ乳がん組織内のがん幹細胞集団内に潜んでいる、最も治療抵抗性のがん幹細胞亜集団を見つけ出すため、患者由来のがん組織を用いた。NRP1もしくはIGF1Rに対する抗体を用いて、がん幹細胞を濃縮したのち、バラバラにして、シングルセルRNAシークエンスを行い、1細胞ごとに発現している遺伝子を網羅的に解析した。その結果、NRP1もしくはIGF1R抗体によって濃縮されたがん幹細胞集団は、5つのクラスター(集団)に分かれることを見出した。その中でクラスター1および2に分類されたがん幹細胞は、トリプルネガティブ乳がんが発生するとされる、乳腺前駆細胞とよく似た性質を示していたため、「祖先がん幹細胞」と名づけた。
強心配糖体の投与で祖先がん幹細胞の治療抵抗性が減弱、再発を予防できる可能性
さまざまな解析の結果、祖先がん幹細胞は抗がん剤に対して最も治療抵抗性を示すことがわかった。また、細胞膜タンパク質FXYD3を強く発現するため、FXYD3に対する抗体を用いて取り出せることもわかった。FYXD3は、Naイオンを細胞外へ排出しKイオンを細胞内へ取り込むNa-Kポンプを細胞膜上で保護する役割を持っている。Na-Kポンプの阻害剤である強心配糖体を投与すると、祖先がん幹細胞の治療抵抗性が弱まって、抗がん剤で死滅させられることがわかった。
最後に、術前全身治療前後のトリプルネガティブ乳がん組織を調べた結果、治療に反応せず残存したがん細胞が、強くFXYD3を発現していた。これらの結果から、術前全身治療の際に強心配糖体を加えることによって、トリプルネガティブ乳がんの再発を予防できる可能性が示された。
「さらなる非臨床試験を実施後、臨床試験によって効果が証明され、術前全身治療の標準治療として強心配糖体の追加が実施されるようになれば、乳がん患者の予後の改善に大きく役立てることが期待される」と、研究グループは述べている。
▼関連リンク
・金沢大学 プレスリリース






