既存ホルモン治療薬の効果は不十分、新治療法が望まれる
名古屋大学は11月9日、球脊髄性筋萎縮症(SBMA)を対象とした基礎研究において、早期の運動療法が、異常タンパク質の蓄積を抑えることで運動ニューロンや筋肉の変性を緩和し、マウスモデルの症状を改善することを明らかにしたと発表した。この研究は、同大大学院医学系研究科神経内科学講座の勝野雅央教授、佐橋健太郎准教授、中辻秀朗研究員(筆頭著者)、蛭薙智紀医員(筆頭著者)らの研究グループによるもの。研究成果は「Journal of Cachexia, Sarcopenia and Muscle」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
神経変性疾患や筋疾患において、一般に運動療法は有効であると考えられているが、過負荷な運動や長時間の運動など、運動の方法によっては病状を悪化させる可能性もあり、いつ、どのような強さの運動を行うのが効果的かは十分明らかになっていない。また多くの神経変性疾患や筋疾患では異常なタンパク質が神経細胞や筋細胞に蓄積することで神経系や筋肉が障害されることがわかっているが、運動療法がこれらの異常タンパク質の蓄積にどのような影響を与えるかは十分検討されていない。
ポリグルタミン病の一つであるSBMAは、顔や舌、手足の筋肉が萎縮し、進行性に筋力が低下する神経筋疾患であり、日本で2,000人程度の患者数が推定され、通常男性のみに発症する。日本では治療薬として男性ホルモンであるアンドロゲンの産生を抑える、リュープロレリン酢酸塩が承認されているが、その効果は十分ではなく、新たな治療法の開発も望まれている。SBMAの原因はアンドロゲン受容体遺伝子のCAGリピート配列が異常に延長していることあるが、この延長したCAGリピートからは、アミノ酸の一種であるグルタミンの繰り返しであるポリグルタミンが生じる。そしてポリグルタミンを含む異常なアンドロゲン受容体タンパク質(ポリグルタミンタンパク質)がアンドロゲンと結合することで細胞の核内に移行し、核内に凝集体を形成することで運動ニューロンや骨格筋が障害されると考えられている。
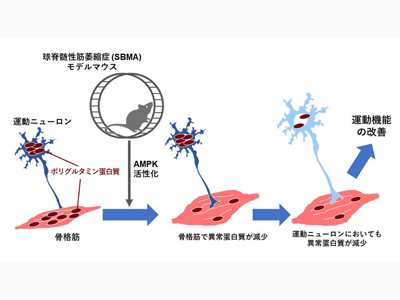
研究グループはこれまでに、異常アンドロゲン受容体を持つSBMAモデルマウスを作成している。SBMAモデルマウスのオスでは運動ニューロンや骨格筋の細胞内に異常アンドロゲン受容体タンパク質が核内に蓄積し、神経筋変性が生じることがわかっている。今回、運動療法の効果を検証するため、一定期間かご走行運動を行なったマウスと、運動を行なっていないマウスを比較し、異常なアンドロゲン受容体タンパク質の蓄積や神経筋変性への効果を調べた。
発症早期のマウスは低負荷の運動実施により生存期間が延長し、症状が緩和
はじめに、かご走行運動装置を用いて、SBMAモデルマウスがどのような強さの運動が可能かを調べた。発症前〜発症早期に低負荷(5m/分)の運動であれば、マウスは1時間途切れずに運動することが可能だったが、進行期のマウスは同じ負荷でも運動の継続が困難だった。また、早期、進行期のマウスともに、高負荷(10m/分)の運動は困難だった。そこで早期に低負荷の運動を1日1時間、4週間(5週齢から9週齢)行うこととした。その結果、運動を行ったマウス(運動群)は運動を行なっていないマウス(非運動群)と比較し、生存期間が延長し、ロタロッドテストによる運動機能の評価では運動障害が緩和された。また、この運動機能の改善は運動期間の終了後も長期間継続した。
運動により、ポリグルタミンタンパク質の凝集体形成が抑制される
次に、ウェスタンブロット法を用いて、進行期(13週齢)のSBMAモデルマウスの異常アンドロゲン受容体を調べたところ、運動群では非運動群と比べて、骨格筋や脊髄での凝集体や単量体の量が低下していた。またポリグルタミンタンパク質を認識する抗体を用いて組織の染色を行ったところ、運動群の骨格筋や運動ニューロンでは核内の凝集体の数が減少していた。さらに、骨格筋の筋細胞や脊髄の運動ニューロンの萎縮も運動群で改善していた。これらの結果から、早期期間に運動を行うことで、骨格筋や運動ニューロンでの異常アンドロゲン受容体タンパク質の量が低下し、凝集体の形成が抑制され、SBMAモデルマウスの神経筋変性が緩和したものと考えられた。
骨格筋AMPKシグナル活性を介してポリグルタミンタンパク質の蓄積抑制、症状改善
早期の運動によりポリグルタミンタンパク質の量が低下した機序を解明するため、運動期間が終了した直後のマウス(9週齢)の組織を調べた。骨格筋では運動群で異常アンドロゲン受容体タンパク質の量や凝集体が低下していたが、運動ニューロンでは低下していないことがわかった。そこで、早期の運動はまず骨格筋の変性を改善していると考え、9週齢のSBMAモデルマウスの骨格筋で網羅的遺伝子発現解析を行った。その結果、運動群の骨格筋では非運動群と比較し、ミトコンドリアの遺伝子の発現が上昇していることがわかった。
これまでの研究で、運動によるミトコンドリアの増加にはAMPKシグナル経路の活性化が重要であることが報告されていたことから、ウェスタンブロット法を用いて骨格筋のAMPKを調べたところ、運動群でAMPKのリン酸化が増加していた。また興味深いことに、運動群の骨格筋では、タンパク質の合成経路が抑制されていることが明らかとなり、AMPKシグナルの活性化は、タンパク質合成を全体に低下させることで異常アンドロゲン受容体タンパク質の蓄積を抑えていることが示唆された。実際に、C2C12と呼ばれる骨格筋のモデル細胞にAICARというAMPKシグナルを活性化する薬剤を加えたところ、運動と同様にタンパク質の合成が抑制され、異常アンドロゲン受容体タンパク質の凝集体が低下した。
研究の結果、早期に一定期間低負荷の運動を行うことで、SBMAモデルマウスにおける骨格筋のAMPKシグナルが活性化し、ポリグルタミンタンパク質の凝集が抑制されることが明らかとなった。また骨格筋変性が改善することで、骨格筋とつながっている運動ニューロンの変性や凝集体形成も緩和され、長期にわたる運動機能の改善や生存期間の延長につながったものと考えられた。
SBMAを含むポリグルタミン病の新しい治療法開発に期待
SBMAなどのポリグルタミン病では早期に低負荷の運動を一定期間行うことで、異常アンドロゲン受容体タンパク質(ポリグルタミンタンパク質)を原因とした神経筋変性が緩和できる可能性が示されました。一方、筋力低下の症状が進行した後では、低負荷の運動であっても一定期間の継続が困難であることも示唆された。「今後は運動への耐久性を評価するバイオマーカーの確立が望ましく、それらの指標をもとに運動の方法を決定することが、個々の患者に合わせた最適な運動療法の開発につながるものと考えられる。また、AMPKシグナルを活性化する方法を開発できれば、SBMAを含むポリグルタミン病の新しい治療法の開発にもつながると考えられる」と、研究グループは述べている。
▼関連リンク
・名古屋大学 研究成果発信サイト






