大腸がんの悪性との関与が示唆される腫瘍間質、成分の多くが未解明
京都大学は10月27日、がん細胞と腫瘍の中のがん細胞以外の組織や細胞(腫瘍間質)の相互作用に着目し、トロンボスポンジン-1(Thrombospondin-1:THBS1)というタンパク質が高悪性度大腸がんの転移形成において重要な役割を果たすことを発見したと発表した。この研究は、同大大学院医学研究科消化器内科の妹尾浩教授、中西祐貴助教、尾松万悠紀研究員らの研究グループによるもの。研究成果は、「Nature Communications」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
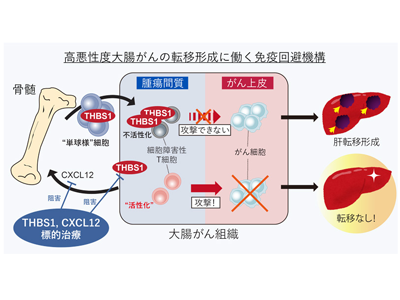
大腸がんは、患者数と死亡数が増加しており、新しい治療戦略開発の必要性が高まっている。予後が改善しない要因のひとつとして、高い転移能と治療抵抗性を持つ「悪性度が高い」大腸がんが全体の約20%を占めていることが挙げられる。このタイプの大腸がんは、腫瘍間質を多く含んでおり、腫瘍間質ががんの高悪性化に関わる可能性が示唆されてきた。ただし、腫瘍間質はさまざまな成分で構成されており、その多くがいまだに解明されておらず、新しい治療戦略の開発につながる発見が限られているのが現状である。今回の研究では、新たな治療標的を見つけるため、腫瘍間質内に存在する細胞外基質タンパク質であるTHBS1に注目し、そのがん進展への影響を詳しく解析した。
腫瘍間質で特異的に発現するTHBS1を発見、ノックアウトマウスで腫瘍転移の抑制を確認
最初に、ヒトの大腸がんの組織染色を行い、THBS1が腫瘍間質で特異的に発現していることがわかった。THBS1の働きを理解するために、マウスの大腸がん細胞をマウスの大腸に移植することで、人間のがんの進展や転移を模倣するモデルを作成し、THBS1の発現をなくしたマウス(THBS1ノックアウトマウス)を用いて実験を行った。この結果、THBS1ノックアウトマウスの腫瘍では、肝臓やリンパ節への転移が抑制され、生存期間も改善することがわかった。THBS1ノックアウトマウスにできるがん組織を解析したところ、腫瘍内に活性化した免疫細胞(細胞障害性T細胞)が増えていることが明らかになり、このことが転移抑制の理由である可能性が示唆された。この仮説を確認するため、免疫細胞を除去する実験を行った結果、再び転移が見られるようになった。これにより、THBS1は免疫細胞の働きを抑えることで転移形成を促進させることが明らかになった。
CXCL12により腫瘍に誘導された骨髄細胞がTHBS1を高発現
さらに、THBS1がどの細胞から分泌されているのかを解明するために、腫瘍内の個々の細胞の遺伝子発現データを分析した。その結果、腫瘍内の骨髄系細胞の一種がTHBS1を最も多く発現していることがわかり、THBS1の分泌源である可能性が示唆された。骨髄系細胞は骨髄で発生し、その後腫瘍に移動する細胞である。骨髄移植により、蛍光色素で標識され、移動を追跡することができる骨髄細胞をもったマウスを作製し、腫瘍を形成させたところ、実際に骨髄系細胞が腫瘍内に呼び寄せられ、その細胞がTHBS1を発現しているということが確認できた。さらに、THBS1ノックアウトマウスにおいて、正常なマウスの骨髄細胞を移植したところ、転移が再び見られるようになった。このことから、骨髄から呼び寄せられる細胞が分泌するTHBS1が転移形成に重要であることが明らかになった。治療の観点から、この骨髄由来細胞を誘導する因子を調べたところ、CXCL12というタンパク質がTHBS1を分泌する細胞を誘導する作用を持つことを発見し、CXCL12の阻害により転移を抑制できることを示した。今回の研究の結果から、大腸がんの転移における骨髄の重要性が明らかになり、さらに、THBS1の阻害ががんの転移を抑える新たな治療法となる可能性が示唆された。
THBS1の阻害、新たな転移抑制治療のターゲットとして有望
転移の有無はがんの予後に大きな影響を及ぼす。遠隔転移を伴う場合、手術による根治治療が難しく、主に化学療法が用いられる。もし転移を予防できる手段があれば、手術できる患者の幅が増え、既存の治療法との組み合わせによる効果向上が期待できる。今回の研究で、THBS1をターゲットにする治療が新たな転移抑制法として有望であることを示し、大腸がんの治療戦略に新たな道を開拓した。さらに、THBS1は他の高悪性度のがん種でも強く発現していることが知られている。このことから、今回の研究の成果は大腸がんだけでなく、他のがんにおける転移抑制治療法の開発にも応用できる可能性がある。「今後の展望としては、THBS1の阻害法の有効な方法の開発と、さまざまながん種への応用に向けた研究を進める予定」と、研究グループは述べている。
▼関連リンク
・京都大学 最新の研究成果を知る



