RpA1が形成する複合体、脊髄小脳失調症1型の病態への関連は未解明だった
東京医科歯科大学は10月12日、脊髄小脳失調症1型の病態へ関与すると知られるRpA1について、DNA損傷修復においてRpA1が構成する2つの複合体に異なる機能があることを明らかにしたと発表した。この研究は、同大難治疾患研究所神経病理学分野の岡澤均教授、トロント大学小児病院のChristopher Pearson教授らの研究グループによるもの。研究成果は、「Cell」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
脊髄小脳失調症1型は、常染色体優性(顕性)の家族性の神経変性疾患である。Ataxin-1(Atxn1)遺伝子の中のCAG塩基配列の繰り返し(CAGリピート)数が多くなる「CAGリピート伸長」が原因であることがわかっている。日本では非常にまれな疾患で、700~2,000人程度の患者が罹患していると言われているが、欧米では頻度がより高いことが知られている。小脳ニューロンの変性のために、小脳失調がおきて歩行や日常動作が困難になる、あるいは一部の患者には、脊髄運動ニューロンの変性のために、筋力低下や筋萎縮がおきるなどの症状が知られている。現時点では、根本的な治療法は確立していないが、研究グループは、HMGB1の遺伝子治療が有効であることを発見し、開発を進めている。
さらに、研究グループは以前、脊髄小脳失調症1型の原因遺伝子(変異Atxn1)を発現する疾患モデルショウジョウバエに、病態に影響を及ぼす可能性があるDNA損傷修復遺伝子を同時に発現させて、寿命、運動機能などへの影響を調べる、病態修飾遺伝子スクリーニングを行い、RpA1が最も強力な寿命延長ならびに症状改善効果を持つことを発見した。さらに、変異Atxn1ノックインマウスにおいてAAV-RpA1が症状改善効果を持つことを報告している。一方、RpA1はRpA2、3、4と3量体(複合体)を形成することが知られており、今後の治療開発のためにも、RpA1の関与する病態機能のさらに詳細な解析が待たれている。
正規型/代替型RpA1複合体を解析、正規型RpA1のAAV遺伝子治療はモデルマウス症状改善
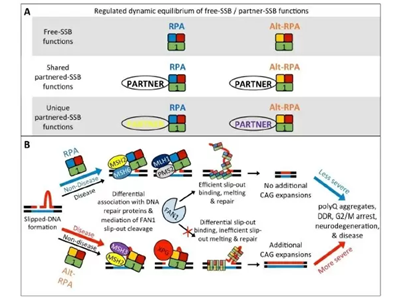
今回、研究グループは、RpA1が他のRpAファミリー分子とともに形成する複合体において、正規型RpA1複合体(canonical RpA)と代替型RpA1複合体(Alternative-RpA1)の間で機能が異なること、すなわち、正規型RpA1はDNA損傷修復を促進して脊髄小脳失調症の原因であるCAGリピートを維持もしくは短縮するのに対して、代替型RpA1はDNA損傷修復を阻害してCAGリピート伸長につながることを明らかにした。
また、変異Atxn1ノックインマウス小脳においてAAV-RpA1がCAGリピートを短縮し、症状改善につながることも改めて確認された。
代替型RpA1複合体、DNA損傷認識後の複合体形成に違い
加えて、RpAファミリー(RpA1、2、3、4)の病態下の遺伝子発現、インタラクトームについても詳細な解析を行った。その結果、正規型RpA1複合体と代替型RpA1複合体では、DNA損傷認識後の一連の複合体形成に違いがあり、最終的にCAGリピートへの影響が異なると考えられた。
AAV-RpA1遺伝子治療の実用化に期待
今回の研究成果は、主に2つの点で意義があると考えられる。第一には、RpA1によるDNA損傷修復とCAGリピート体細胞変異の関係がより明確になったことである。正規型RpA1複合体と代替型RpA1複合体では、DNA損傷認識後の一連の複合体形成に違いがあり、最終的にCAGリピートへの影響が異なると考えられた。第二には、RpA1の治療効果が再度確認されたということである。AAV-RpA1による遺伝子治療は、主に正規型RpA1複合体を活性化し、これによってCAGリピート伸長を抑制することが改めて確認された。「RpA1の治療応用に関する特許はすでに取得しており、今後の実用化が期待される」と、研究グループは述べている。
▼関連リンク
・東京医科歯科大学 プレスリリース



