RNAワクチン、SARS-CoV-2への応用が進んだ一方で免疫誘導メカニズムは未解明部分が多い
東北大学は9月27日、ビタミンEを構造内に含む人工脂質を用いて脂質ナノ粒子(LNP:Lipid Nanoparticle)を作製し、メッセンジャーRNA(mRNA)を組み込むと、がんや感染細胞を殺傷する免疫細胞のキラーT細胞を強く活性化するRNAワクチンとして働くことを見出したと発表した。この研究は、同大大学院薬学研究科の秋田英万教授、理化学研究所生命医科学研究センターの岡田峰陽チームリーダー、同センターの石亀晴道上級研究員(当時)、千葉大学大学院医学薬学府後期博士課程3年の大山遼太朗氏ら研究グループによるもの。研究成果は、「ACS Nano誌」電子版に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
RNAワクチンは、病原体の目印となる「抗原」を遺伝子情報としてmRNAに組み込み、生体内でタンパク質がつくられるようにした製剤だ。mRNAを生体内の細胞の中に届けるために、LNPが使用されている。SARS-CoV-2に対して迅速な応用が進んだ一方、その免疫誘導メカニズムには未解明な部分が多い。
研究グループは今回、細胞性免疫を強く誘導するRNAワクチンに資するLNPを創出し、その免疫誘導機構を解明するための研究を行った。
mRNA封入LNP、ビタミンE構造を持つものはI型IFNシグナルを介して免疫を誘導
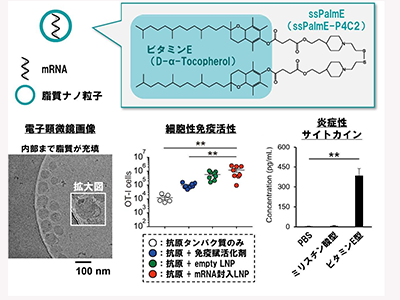
研究グループはマウスモデルを用いて、細胞性免疫の活性を基準にmRNA封入LNPの条件検討を行い、脂質の組成、脂質とmRNAの配合比、調製条件に関して検討した。このようにして得られた効果的なRNAワクチンは、マウスにおいてがんや細胞内寄生原虫の感染に対してワクチン効果を発揮した。
続いて、RNAワクチンのどのような性質が、自然免疫の活性化に関わるかマウスを用いて検討した。その結果、LNPを構成する脂質の中でも、イオン化脂質と呼ばれる成分の脂溶性構造の違いが、免疫応答に寄与していることを見出した。特に、イオン化脂質の脂溶性ユニットとしてビタミンEを採用すると、種々の免疫を活性化するサイトカインが血液中に誘導されることが明らかとなった。この応答は、mRNAの有無に関わらず観察されることや、脂溶性ユニットを脂肪酸に入れ替えた場合は、観察されなかった。このビタミンE含有脂質から形成されるLNPを投与した際には、サイトカインのI型インターフェロンによる細胞間情報伝達が、誘導されていることが示唆された。そこで、I型インターフェロンの受容体を阻害する抗体を投与したところ、ビタミンE含有脂質から形成されるLNPによる細胞性免疫誘導が減弱した。このことから、ビタミンE構造を持つ脂質が、I型インターフェロンのシグナルを介して、免疫を誘導していることが確認された。
RNAワクチン投与によるキラーT細胞の活性化、cDCが重要
また、研究グループは、ワクチン抗原の情報をT細胞に伝える抗原提示細胞についても着目。RNAワクチンの投与からキラーT細胞の活性化に至るまでの過程を解析した。その結果、樹状細胞の一種である古典的樹状細胞(cDC)が重要であることが判明した。マウスにおいてcDCは、cDC1とcDC2の2種類に分類される。従来の不活化病原体やタンパク質を用いたワクチンでは、cDC1が細胞性免疫の誘導に重要と考えられている。これはcDC1が、細胞外のタンパク質抗原を取り込み、キラーT細胞に抗原提示を行うことで、細胞性免疫を誘導できるクロスプレゼンテーションという能力を備えているためだ。一方で、cDC2はそのような能力が低く、ヘルパーT細胞の活性化への寄与が大きいことが知られている。しかし、今回開発されたRNAワクチンの場合、cDC1の寄与が小さいことが明らかとなった。
投与部位に存在のcDC2がRNAワクチンを取り込み、リンパ節で抗原提示の可能性
これらの結果から、クロスプレゼンテーション能力の低いcDC2がRNAワクチンを取り込んで、自らワクチン抗原を発現することで、キラーT細胞に抗原提示を行なっている可能性が考えられた。実際に、今回開発されたRNAワクチンをマウス生体内で取り込み、ワクチン抗原を発現した免疫細胞の割合を解析したところ、cDC2がその大部分を占めていた。また、皮膚や筋肉などの投与部位にいるcDC2がRNAワクチンを取り込んだ後、リンパ節に移動して抗原提示を行う可能性が見出された。
最後に、リンパ節内の抗原提示の様子を顕微鏡で観察したところ、やはりワクチン抗原を発現した樹状細胞が、抗原特異的なキラーT細胞と相互作用していることが確認されたとしている。
がん治療用RNAワクチン開発の加速などに期待
今回の研究では、LNPを構成する脂質の化学構造によって、免疫応答が異なることを明らかにした。また、生体投与後、移行性cDC2が投与部位付近でLNPを取り込み、抗原を発現し、リンパ節へ移行後、キラーT細胞に抗原を提示する一連の過程をマウスで解析し、RNAワクチンによって細胞性免疫が誘導されるメカニズムを明らかにした。脂質の化学構造が免疫応答に影響することが明らかとなったことから、化学構造の改変により細かな免疫応答の調節をすることで、副作用の少ないRNAワクチン製剤の開発につながる可能性がある。また、免疫応答を起こさずに、目的の細胞にタンパク質補充をするmRNA医薬の創出も期待される。さらに、投与後の一連の過程が見えてきたことによって、細胞性免疫を高めるために標的とする抗原情報を用いてがんなどを治療するためのRNAワクチンの開発がさらに加速されることが期待される、と研究グループは述べている。
▼関連リンク
・東北大学 プレスリリース



