卵巣体細胞は、精巣と同一の前駆細胞からの性分化によって生じる?
東京大学は7月6日、AMH-treckトランスジェニック(Tg)マウス系統を用いて、胎子精巣からセルトリ細胞をジフテリア毒素により実験的に除去することで、精巣上皮から顆粒層細胞を含む卵巣皮質が形成され、精巣間質では卵巣特有の内莢膜細胞が出現することを発見したと発表した。この研究は、同大大学院農学生命科学研究科獣医解剖学研究室の金井克晃教授らの研究グループによるもの。研究成果は、「Development」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
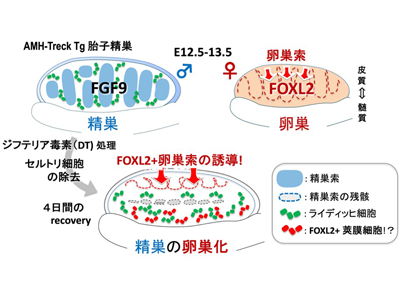
ほ乳類の性別は、胎子期の未分化な性腺が、精子を作る精巣、あるいは卵子を育む卵巣のどちらに発達するかにより決まる。オスの胎子では、未分化な性腺でオス型のセルトリ細胞が誘導され、この誘導されたセルトリ細胞から分泌されるさまざまなパラクライン因子により他の全ての性腺の細胞がオス型へと分化し、その結果として精巣を構築する。一方、メスの胎子では、未分化な性腺でセルトリ細胞の代わりにFOXL2陽性(FOXL2+)の顆粒層細胞が誘導される。結果、セルトリ細胞が誘導されず、パラクライン因子は分泌されないため、他の全ての性腺の細胞がメス型の卵巣へと誘導されることが知られている。これまで、卵巣を構築する卵巣体細胞は、精巣と同一の前駆細胞からの性分化により生じるという概念が主流であり、また卵巣を形作る前駆細胞が、どこに存在し、どのように卵巣を構築するのかは謎に包まれていた。
Tgマウス胎子の精巣からセルトリ細胞を除去、精巣から卵巣へ性転換が誘導された
研究グループは、セルトリ細胞に特異的にジフテリア毒素(DT)受容体を発現するAMH-treck Tgマウスを独自に作出しており、これを利用して、胎齢12.5日の胎子の精巣からセルトリ細胞を除去し、その後の残された精巣の動態をRNA-seqにより継時的な遺伝子の発現変化を解析した。その結果、セルトリ細胞除去後、Foxl2、Fst、Gng13などを含む39遺伝子(35.1%)、102遺伝子(22.0%)の卵巣特異的遺伝子が時間経過とともに上昇することが判明した。卵巣体細胞マーカーであるFOXL2+細胞は、精巣上皮の下層、中腎側の間質領域に別々に出現し、さらに生き残った生殖細胞も減数分裂を開始しメス型に分化していた。つまり、セルトリ細胞除去後、精巣から卵巣への性転換が誘導されたことが判明した。
FOXL2+の卵巣前駆細胞が精巣上皮とライディッヒ細胞周辺に存在
上皮直下で誘導されたFOXL2+細胞は、卵巣でみられる皮質索様の肥厚(卵巣索)に類似し、卵巣索マーカーであるLgr5、Gng13の発現誘導も確認された。精巣上皮のQdot probe(蛍光ナノクリスタル)標識による追跡実験、EdUによる細胞増殖解析により、FOXL2+細胞の一部は、精巣上皮からの増殖を経て出現していることが判明し、セルトリ細胞の除去により精巣上皮からのFOXL2+顆粒層細胞を含む卵巣索が形成されていることが証明された。
一方、中腎側のFOXL2+細胞は、ライディッヒ細胞に近接して出現し、GFP標識の中腎細胞の追跡実験、さまざまなマーカーの発現解析から内莢膜細胞に相同する細胞であることが示唆された。さらに、この性転換に関与するセルトリ細胞のパラクライン因子として、さまざまな分泌因子の中でもFGF9の添加のみでTg精巣でのFOXL2発現誘導が抑制されること、FGFR1/2受容体とヘパラン硫酸プロテオグリカン(FGFリザーバー)が上皮・中腎側領域で発現していることから、胎子セルトリ細胞からのFGF9供給の停止が、精巣から卵巣への性転換の引き金となったものと想定された。
ほ乳類の生殖腺の機能障害について、病因・病態の理解に貢献できる可能性
以上の結果から、胎子精巣内で、メス型の顆粒層細胞、内莢膜細胞の前駆細胞が維持されていること、精巣内でのこれらの卵巣組織は、セルトリ細胞から分泌されるFGF9により、その発達が抑制されていることが判明した。「本研究結果は、精巣と卵巣の体細胞はお互い同一の前駆細胞が存在し、同一の前駆細胞が性分化するという今までの概念とは異なる。この精巣内で卵巣前駆細胞が維持されている新知見は、マウスだけでなく、ヒトや家畜の性分化異常症での性的2型の破綻の原因の一つとして、ほ乳類の生殖腺の機能障害の病因、病態の深い理解に貢献する」と、研究グループは述べている。
▼関連リンク
・東京大学大学院農学生命科学研究科・農学部 研究成果



