有効な臨床効果を得たaAVCワクチン、長期間の抗腫瘍効果持続が課題
理化学研究所(理研)は7月3日、白血病マウスモデルに対する「人工アジュバントベクター細胞(aAVC)」ワクチンとサイトカインの併用療法の開発に成功したと発表した。この研究は、理研生命医科学研究センター免疫細胞治療研究チームの清水佳奈子上級研究員、藤井眞一郎チームリーダーらの研究グループによるもの。研究成果は、「Journal for ImmunoTherapy of Cancer」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
研究グループは、がんや感染症に対して自然免疫と獲得免疫を賦活化する「人工アジュバントベクター細胞(aAVC:エーベック)ワクチン」を独自に開発し、研究を進めている。最近、再発性・治療抵抗性(進行期)の急性骨髄性白血病の患者に対して、WT1抗原発現aAVC(aAVC-WT1)を投与し治療する、First in humanの医師主導治験第一相試験を行った。治験では、自然免疫と獲得免疫の両方を誘導でき、キラーT細胞を長期に誘導できる記憶免疫効果、および白血病細胞の低下を指標とする有効な臨床効果が得られた。一方で、完全な治癒には至らなかったことから、抗腫瘍効果をより長期間持続させる方法を開発する必要がある。
サイトカインとaAVCワクチンの併用療法を検討、IL-2に着目
進行期のがん患者では、化学療法などの治療や病態により、免疫細胞、特にリンパ球の数や増幅能が低下している。さらに、一般に進行期がんでは免疫にブレーキをかける制御性T細胞(Treg)が増殖するため、免疫を賦活化するには免疫環境を変える必要がある。そこで、より効果的な治療戦略のためのリバーストランスレーショナル研究として、aAVCワクチンと、がんに免疫応答するエフェクター細胞をさらに増幅し得るサイトカインの併用療法を検討した。
研究グループは、インターロイキン-2(IL-2)というサイトカインに着目した。IL-2は1980年代からナチュラルキラー(NK)細胞やT細胞を増幅させる目的でがん免疫療法に使用され、1992年に米国食品医薬品局(FDA)で転移性腎がん、1998年には転移性悪性黒色腫の治療に認可された。しかし、IL-2は体内では半減期が15分以下と短く、また血管内皮細胞がIL-2受容体(CD25)を発現するため、毛細管漏出症候群を引き起こすなどの副作用の問題がある。また、CD25を発現する制御性T細胞も増幅してしまうため使用が難しいことから、現在IL-2による新しい治療法の研究・開発が行われている。
受容体への感受性異なるIL-2と抗IL-2抗体の複合体2種類を比較
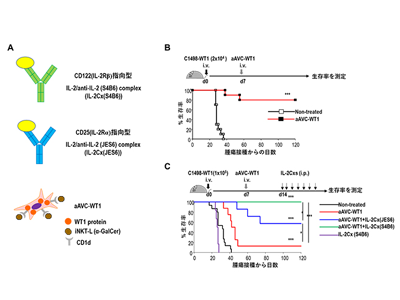
IL-2受容体(IL-2R)には、CD25(IL-2Rα)、CD122(IL-2Rβ)、CD132(IL-2Rγ)の三つのサブユニットがあり、これらがヘテロ二量体や三量体の状態で存在している。これらのサブユニットは、エフェクター細胞の種類や活性化状態により細胞表面での発現パターンが異なることが知られている。そこで今回、IL-2受容体への感受性の異なる2種類のIL-2と抗IL-2抗体の複合体(IL-2Cx)を用いて、治療効果を調べた。
研究グループは、治験においてaAVC単独投与では治療の難しかった高腫瘍量群に対する治療効果を引き上げるため、aAVCにCD122指向型IL-2Cx(S4B6)およびCD25指向型IL-2Cx(JES6)をそれぞれ併用し、比較検討した。CD122指向型IL-2Cx(S4B6)は通常、CD122を高発現するNK細胞や記憶免疫CD8陽性T細胞に作用しやすく、CD25指向型IL-2Cx(JES6)はCD25を高発現する制御性T細胞に作用しやすいという特徴がある。
aAVC+CD122指向型「IL-2Cx(S4B6)」併用投与で、高白血病腫瘍量マウス全てが長期生存
まず、マウスに通常量のWT1発現白血病細胞(C1498-WT1)を投与し、WT1発現aAVC(aAVC-WT1)で治療すると、80%のマウスが生き残った。その生き残ったマウスに3~6か月後、C1498-WT1を再度投与したところ、全てのマウスに抗WT1特異的な記憶免疫T細胞が誘導され、がん細胞を拒絶できることがわかった。
次に、マウスに通常の5倍量のC1498-WT1を投与し、aAVC-WT1で治療したところ、その効果が腫瘍接種から40日後には約50%に、60日後には約20%まで低下することを確認した。そこで、この高腫瘍量マウスにaAVC-WT1での治療後7日目から、2種類のIL-2Cxのうち1種類を7日間投与した。すると、IL-2Cx(JES6)併用群では60%以上のマウスが腫瘍接種から80日以降まで生存し、IL-2Cx(S4B6)併用群では100%のマウスが180日以上生存した。つまり、この併用療法で高腫瘍量マウスの免疫を賦活化でき、特にIL-2Cx(S4B6)併用群で効果が高いことがわかった。一方、aAVC-WT1を用いないIL-2Cx(S4B6)単独投与群では、生存率は未治療群と変わらなかった。
IL-2Cx(S4B6)の併用、NK/NKT/CD8陽性T細胞を有意に増幅
この抗腫瘍効果のメカニズムを明らかにするために、aAVC-WT1の代わりにOVA抗原を発現したaAVC-OVAでの治療後、IL-2Cxを投与した白血病マウスモデルの免疫細胞の数を解析した。その結果、自然免疫をつかさどるナチュラルキラーT(NKT)細胞については、aAVC-OVA単独投与群に比べて、IL-2Cx(S4B6)併用群、IL-2Cx(JES6)併用群ともに、抗腫瘍効果を発揮するインターフェロンガンマ(IFN-γ)産生性のNKT細胞が増加していた。NK細胞については、IL-2Cx(S4B6)併用群で有意に増加し、特に分化の中間段階にあるNK細胞(増殖能と細胞傷害活性を持つ)が著しく多く見られた。一方、獲得免疫をつかさどるCD8陽性T細胞についても、IL-2Cx(S4B6)併用群で著しく増加した。これらの結果は、IL-2Cx(S4B6)併用群では、がん細胞を攻撃できるエフェクター細胞(NK細胞、NKT細胞、CD8陽性T細胞)が有意に増幅され、強力な抗腫瘍効果を誘導できることを示している。
aAVCを投与すると、活性化した各々のエフェクター細胞のIL-2受容体は投与前には発現していなかったCD25やCD122を発現するというように発現パターンが変化する。このIL-2受容体の発現パターンの経時的な変化とエフェクター細胞数の増加には整合性が見られた。
さらに、エフェクター細胞の質について解析した。aAVC-OVA単独投与群やIL-2Cx(JES6)併用群では、抗原刺激を受け活性化し、細胞傷害活性を持ったエフェクターCD8陽性T細胞(CD44highCD62L-)が優位に誘導された。これに対して、IL-2Cx(S4B6)併用群では、主として記憶免疫T細胞の一種で、自己複製能力の高いセントラルメモリーCD8陽性T細胞(CD44highCD62L+)に近いタイプが誘導されたことがわかった。他の表現型をみると、IL-2Cx(S4B6)併用群では、「幹細胞様記憶免疫CD8陽性T細胞」(KLRG1-CD127+CXCR3+CD27+Sca-1+)という長期間持続的に機能するエフェクター細胞に分化できる細胞群が誘導されたことがわかった。
IL-2Cx(S4B6)併用群の幹細胞様記憶免疫CD8陽性T細胞に関与する転写因子を調べたところ、転写因子TCF1が強く発現しており、幹細胞様記憶免疫CD8陽性T細胞の誘導にTCF1が関わっていることがわかった。実際、抗原特異的CD8陽性T細胞を解析すると、IL-2Cx(JES6)併用群は短期間ではaAVC-OVA単独投与群に比べて3倍以上のT細胞応答が起こったが、約60日間経過するとaAVC-OVA単独投与群と同じくらいまで低下した。一方、IL-2Cx(S4B6)併用群は短期間でaAVC-OVA単独投与群の約8倍のT細胞応答が起こり、さらに160日を経過しても2倍以上の記憶免疫CD8陽性T細胞が持続することがわかった。
CD8/Treg比、IL-2Cx(S4B6)併用群で著しく上昇
一方で、抑制性の制御性T細胞への影響も明らかになった。制御性T細胞はCD25を高発現し、IL-2によって増幅される。また、がん細胞が増加する際には制御性T細胞も増加することが知られている。エフェクター細胞であるCD8陽性T細胞と制御性T細胞の比(CD8/Treg比)は、予後のマーカーとなることも報告されている。CD8/Treg比は、aAVC単独投与だけでも上昇するが、IL-2Cx(S4B6)併用群では著しく上昇すること、IL-2Cx(JES6)併用群では逆に低下することが判明した。
S4B6併用群のみ、骨髄で幹細胞様マーカーを呈するNK/CD8細胞集団が増加
さらに、白血病の腫瘍部位である骨髄を詳しく解析した。すると、白血病細胞(C1498-WT1)投与後21日目において、IL-2Cx(S4B6)併用群では、NK細胞とCD8陽性T細胞において他の群とは異なる発現パターンを示す集団が増加した。いずれも幹細胞様マーカー(Klrg1-CD62L+TCF1+)を呈する集団であり、最終的に主成分分析(PCA)により、このような記憶免疫NK細胞と記憶免疫CD8陽性T細胞は、表現型の発現パターンが非常に類似していることが検証された。
以上の結果から、aAVCとIL-2Cxの併用療法では、aAVCで誘導されたエフェクター細胞を若返らせ、その数を増幅させることで強力な抗腫瘍効果をもたらしたと考えられる。特にaAVCとIL-2Cx(S4B6)の併用療法において、著しい効果が見られた。
aAVCとIL-2Cxの併用、自然免疫と獲得免疫の増強と長期維持が期待できる
今回の研究では、aAVCとIL-2Cxを併用することにより、体内において長命かつ持続的にエフェクター細胞を供給できる幹細胞様の記憶免疫NK細胞および記憶免疫CD8陽性T細胞の増幅、つまり自然免疫と獲得免疫の増強・長期維持に成功した。この併用療法は、腫瘍免疫環境において制御性T細胞の数を制限することもわかった。
「このような抑制性免疫の改善と免疫賦活作用を同時に誘導することで免疫環境を変化させ、腫瘍量の多い白血病マウスモデルにおいても効果があることを示したことは、今後、分子標的療法や抗がん剤に対して抵抗性になった症例において、有効な手立てになると期待できる」と、研究グループは述べている。
▼関連リンク
・理化学研究所 プレスリリース




