パーキンソン病、真の凝集αシヌクレイン受容体は?
東北大学は6月13日、パーキンソン病原因タンパク質凝集αシヌクレインについて、脳内で拡大・蓄積するメカニズムを明らかにしたと発表した。この研究は、同大大学院医学系研究科神経内科学分野の長谷川隆文准教授、石山駿医員らの研究グループによるもの。研究成果は、「The FASEB Journal」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
パーキンソン病をはじめとする神経変性疾患患者の脳内では、各々の疾患に特有の異常凝集タンパク質が検出され、病態の主役と考えられている。これらの凝集タンパク質は神経細胞間を伝播し、周辺細胞へと病変を拡大させ、病態を進行させると推定されている。凝集タンパク質が細胞内へ侵入するルートとして複数の可能性が考えられているが、中でも、エンドサイトーシスが注目されている。パーキンソン病では、複数の膜タンパク質が凝集αシヌクレインのエンドサイトーシス受容体として報告されている。一方、そのほとんどは網羅的探索で見出されたものではなく、神経細胞で発現が認められない等の問題があった。このような状況の中、先入観のない網羅的な手法による真の凝集αシヌクレイン受容体探索が求められている。
界面活性剤を用いずに膜タンパク質ライブラリ作出、脳に発現の受容体を網羅的探索
通常、疎水性の高い受容体タンパク質の単離/精製には、可溶化能の高い界面活性剤が用いられる。しかし、同剤は受容体タンパク質の構造・機能に影響を与え、タンパク質の同定に用いる質量分析法とも相性が悪いという欠点を有している。これらの問題を克服するため、今回研究グループは界面活性剤を用いない膜融合法により、プロテオリポソームで構成される全脳由来の膜タンパク質ライブラリを新たに作出。さらに、同ライブラリを出発材料としてアフィニティークロマトグラフィーと質量分析法を組み合わせ、脳組織に発現する凝集αシヌクレイン受容体の網羅的探索を行った。
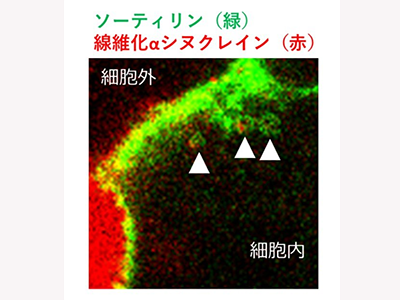
ソーティリン、凝集αシヌクレインのエンドサイトーシス受容体として機能
その結果、神経・オリゴデンドログリア細胞に高発現するソーティリンの細胞外領域(10CCドメイン)が凝集αシヌクレインと強く結合すること、ソーティリンが凝集αシヌクレインのエンドサイトーシス受容体として機能すること、αシヌクレインの取り込みがソーティリン発現抑制・ソーティリン10CCドメイン抗体により有意に抑制されることを発見した。
患者脳組織にソーティリン集積を確認、発現は病理ステージ毎に変動
パーキンソン病および類縁疾患である多系統萎縮症の脳組織において、凝集αシヌクレイン陽性のレビー小体・グリア細胞内封入体にソーティリンが集積していることがわかった。パーキンソン病中脳黒質の全転写産物データを用いた解析により、ソーティリンの発現が病理ステージ毎に変動することが明らかになった。
パーキンソン病関連疾患の病態解明・進行抑制治療薬開発に期待
パーキンソン病とその類縁疾患においては、凝集αシヌクレインの細胞間伝播が病態進行の鍵を握る現象であると考えられている。今回、凝集αシヌクレインの細胞への取り込みを担う受容体としてソーティリンが同定されたことで、これらの疾患の病態解明が進むと同時に、凝集タンパクの伝播阻止に立脚した新たな進行抑制治療開発への道が開かれることが期待される、と研究グループは述べている。
▼関連リンク
・東北大学 プレスリリース




