NaチャネルNav1.1/Nav1.2発現神経細胞の種類や割合の詳細は不明だった
名古屋市立大学は6月1日、大脳皮質、海馬においてNav1.1およびNav1.2を発現する神経細胞の種類や、その分布の詳細を明らかにしたと発表した。この研究は、同大大学院医学研究科 脳神経科学研究所 神経発達症遺伝学分野の山川和弘教授、山形哲司特任助教、鈴木俊光講師、日本医科大学 医学部 システム生理学の荻原郁夫准教授、理化学研究所 脳神経科学研究センター 神経遺伝研究チーム(山川チームリーダー)の立川哲也研究員(研究当時)、行動遺伝学研究チームの糸原重美チームリーダー(研究当時)らの共同研究グループによるもの。研究成果は、「eLife」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
電位依存性ナトリウムチャネル(Navチャネル)は、神経細胞などの細胞膜上でナトリウムイオンを透過する通路を形成して、活動電位の発生と伝播、脳内の情報伝達に必須の役割を果たしている。Navチャネルは、1つの主要なαサブユニットと、その動態や細胞内輸送を制御する1つまたは2つの補助的なβサブユニットによって構成されている。ヒトには9つのαサブユニット(Nav1.1 Nav1.9)と4つのβサブユニット(β1 β4)がある。αサブユニットのうち、SCN1A、SCN2A、SCN3A、SCN8A遺伝子にコードされるNav1.1、Nav1.2、Nav1.3、Nav1.6タンパク質が、中枢神経系に発現する。
胎生期にはSCN3Aが主に発現しており、出生後は主にSCN1A、SCN2A、SCN8Aが発現する。これら3つの遺伝子は、てんかん、自閉スペクトラム症、知的障害など幅広い神経疾患で変異が見つかっており、中でもSCN1Aはてんかんで、SCN2Aは知的障害・自閉症で最も頻度高く変異が見られる遺伝子だ。これらの疾患を引き起こす神経回路を理解するためには脳内で原因遺伝子を発現する細胞の種類やそれらの詳細な分布/接続回路を正確に知ることが不可欠だが、当初、Nav1.1は海馬興奮性神経細胞での発現(Nav1.1は細胞体、Nav1.2は軸索)が報告されたり、シングルセルRNAシークエンシングの結果から全ての神経細胞にNav1.1、Nav1.2、Nav1.6が全て発現するとされるグループが存在しているなど、現在でもやや混乱が続いている状況だ。
山川教授らの研究グループは以前に、Nav1.1がパルブアルブミン(PV)陽性抑制性神経細胞(抑制性神経細胞の中でも最も数が多く、高頻度に発火して興奮性神経細胞を根元から強力に抑制する細胞)に強く発現することや、海馬興奮性神経細胞には発現が見られないこと、大脳皮質にはNav1.1を発現している興奮性神経細胞が存在すること、Nav1.1およびNav1.2の発現が多くの脳領域で相互に排他的であることなどを報告している。しかし、それら細胞の種類や割合についての詳細は不明だった。
Nav1.1をコードするScn1a遺伝子のGFPレポーターマウスを作製
Nav1.1やNav1.2などのNavチャネルの分布解析が困難な理由の一つに、それらが細胞体ではなく軸索などの神経突起部分に発現が多いことや、発生段階に応じて発現量や発現部位がダイナミックに変化することなどから、往々にして発現細胞そのものを同定し難いことがある。
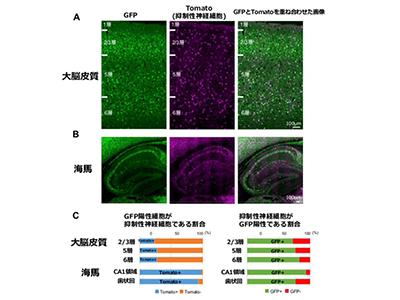
そこで研究グループは今回、Scn1a遺伝子のプロモーター制御下でGFPを発現する遺伝子組換えマウスを作製してNav1.1を発現する細胞をGFPで標識することにより同定し、その分布を免疫組織染色法やmRNA in-situハイブリダイゼーション法などで詳細に解析した。このGFPの発現はScn1a mRNAの分布とよく一致し、大脳皮質では全神経細胞のおよそ2割がGFP陽性細胞であることが明らかになった。
海馬において、Nav1.1は抑制性神経細胞のみで発現
大脳皮質と海馬において、Nav1.1陽性の軸索起始部は全てGFP陽性細胞で観察された。しかし大脳皮質では、GFP発現細胞の軸索起始部の半数弱のみNav1.1陽性であり、大脳皮質GFP発現細胞の多くではNav1.1の発現が非常に弱いか発現部位が細胞体から離れた部分であることが示唆された。海馬では、興奮性神経細胞であるCA1-3領域の錐体細胞と歯状回の顆粒細胞にはGFPの発現がなく、Nav1.1陽性の軸索起始部も観察されないことから、Nav1.1は抑制性神経細胞だけで発現していることが示された。
さらに、Scn1a-GFPマウスと全抑制性神経細胞を特異的に検出できるマウスを掛け合わせて解析し、大脳皮質ではGFP陽性細胞の多く(74%)は興奮性神経細胞であるのに対し、海馬ではそのほとんどが抑制性神経細胞であることが確認された。
Nav1.1とNav1.2は大脳皮質各層で接続経路の異なる神経細胞集団ごとに分かれて発現
大脳皮質の興奮性神経細胞は遠く離れた領域に投射する、大きく分けて4種の細胞(錐体路投射細胞、皮質-視床投射細胞、皮質-線条体投射細胞、皮質-皮質投射細胞)からなることが知られている。錐体路投射細胞は皮質5層に分布して皮質から延髄や脊椎に軸索を伸長している細胞で転写因子FEZF2タンパクを特異的に発現する。一方、皮質-視床投射細胞は6層などに分布し転写因子TBR1を発現しており、FEZF2とTBR1は相互排他的に発現することが知られている。そこで、Scn1a-GFPマウスにおいてFEZF2、TBR1などを興奮性の投射神経細胞のマーカーとして用いて調べた結果、皮質5層の錐体路投射細胞の大半がNav1.1を発現しておりTBR1は発現しないことが明らかになった。
加えて多くの解析を行い、6層の皮質-視床投射細胞などのTBR1陽性細胞の多くがNav1.2陽性であること、5層と6層の皮質-線条体および2層と3層の皮質-皮質投射細胞の大部分は、Nav1.2を発現していること、GFP(Nav1.1)陽性抑制性細胞ではそのほとんどがPV陽性細胞とソマトスタチン(SST)を発現する細胞であることなどが明らかになった。
以上の結果は、大脳皮質の各層において、Nav1.1とNav1.2が接続経路の異なる神経細胞の集団ごとに分かれて発現していることを示すものだとしている。
「ドラべ症候群」における突然死の発症メカニズムを示唆
SCN1A遺伝子の変異は軽症から重症のてんかん、知的障害、自閉症など広い範囲の神経疾患で見出されるが、中でも重症なのがドラベ症候群で、難治てんかん、知的障害や自閉的行動異常、さらには高い割合で突然死を引き起こすことで知られ、およそ8割の患者でSCN1A遺伝子の機能喪失変異が見出される。山川教授らの研究グループは以前に、患者で見られたナンセンス変異のノックインマウスにおけるけいれん発作と突然死、記憶学習障害と社会性行動異常、PV陽性細胞でのNav1.1半減がてんかん発作と突然死のみならず社会性行動異常の主原因でもあること、さらには、Nav1.1が大脳皮質の興奮性神経細胞の一部にも発現し、そこでの半減は逆にてんかん発作・突然死を軽減する効果を持つことを報告している。
特に最後の知見と、別のグループのノックアウトマウスに見られる突然死が副交感神経系の過活動による心停止により引き起こされるとの報告は、今回の研究で見出された「Nav1.1の大脳皮質錐体路投射細胞での発現」と併せ、ドラべ症候群における突然死の発症メカニズムとして、1)大脳皮質PV陽性抑制性神経細胞におけるNav1.1の半減が当該細胞の機能低下をもたらし、2)下流の大脳皮質錐体路投射細胞の脱抑制による過剰興奮、3)さらにはその下流の迷走神経の過剰興奮をもたらし、4)心臓の過剰抑制から心停止を経て突然死につながる、という神経回路を強く示唆することとなった。
てんかんとそれに伴う突然死などの発症メカニズム解明や新規治療法につながる可能性
今回の研究により、大脳皮質、海馬においてNav1.1とNav1.2を発現する神経細胞の種類やその分布が詳細に明らかになった。また今後、このScn1a-GFPマウスを利用することにより、他の脳領域におけるNav1.1発現神経細胞の詳細な分布解析や、これらの細胞を単離して行う解析などが可能となる。
「このような解析は、てんかんやそれに伴う突然死、自閉症スペクトラム障害、知的障害などの発症メカニズム解明や新規治療法、発症予防法の開発につながると期待される」と、研究グループは述べている。
▼関連リンク
・名古屋市立大学 プレスリリース



