重症脳挫傷に対する有効な治療法はなく、iPS細胞を用いた再生医療には腫瘍化リスク
慶應義塾大学は5月18日、ゲノム編集技術とiPS細胞を組み合わせた脳挫傷に対する新規治療法を開発したと発表した。この研究は、同大医学部脳神経外科学教室の戸田正博教授らの研究グループによるもの。研究成果は、「STEM CELLS」オンライン版に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
救急医療の発達に伴い、重症脳挫傷に対する患者の救命率は向上したが、重度の高次・運動機能障害が残存した患者に対しては、いまだ有効な治療法はない。ヒトiPS細胞由来の神経幹細胞(Neural stem cell:NSC)を用いた再生医療では、NSCが生着して機能再生する可能性に加え、NSCにより分泌される神経栄養・保護因子を介して、再生を促進する可能性が期待されている。これまで、NSCの供給源として胎児の細胞の研究が重ねられてきたが、移植細胞数の確保や倫理的な問題があった。
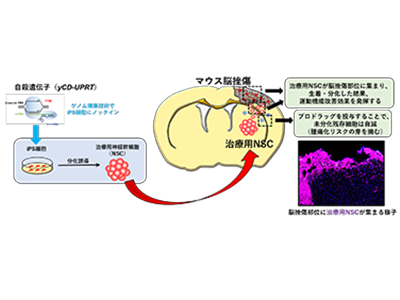
研究グループはこれまで、iPS細胞から誘導したNSCを用いることにより、これらの問題を克服し、さらに自殺遺伝子を導入することで、iPS細胞を用いた再生医療で懸念される移植細胞の腫瘍化リスクを回避する研究を進めてきた。
ゲノム編集技術でiPS細胞に自殺遺伝子を導入し「治療用NSC」を安定供給
研究グループは今回、ヒトiPS細胞の腫瘍化リスク防止の安全装置として「自殺遺伝子」に着眼した。使用した融合自殺遺伝子「yeast cytosine deaminase-uracil phosphoribosyl transferase(yCDUPRT)」は、プロドラックである抗真菌剤「5-Fluorocytosine(5-FC)」を、殺細胞効果を有する「5-Fluorouracil(5-FU)」に変換する酵素の遺伝子。iPS細胞への自殺遺伝子の導入では遺伝子発現が減弱しやすく、また、ウイルスベクターを用いて遺伝子導入した場合、染色体にランダムに自殺遺伝子が挿入されるため、その周辺遺伝子の不活性化や、さらなる腫瘍化などのリスクが生じる。
そこで、ウイルスベクターではなく「CRISPR/Cas9」によるゲノム編集技術を用いて、恒常的に遺伝子発現可能な挿入部位を同定し、自殺遺伝子を導入したiPS細胞を用いて「治療用NSC」の安定供給に成功した。
脳挫傷に対する自殺遺伝子導入「治療用NSC」の有効性・安全性をマウスで証明
脳挫傷モデルマウスにおいて「治療用NSC」を脳内に移植すると、NSCが脳挫傷部位へ集まり、治療用NSCから分化したニューロンが生着し、運動機能改善効果を示した。その機能改善効果には、治療用NSCから分泌される神経栄養・保護因子を介した神経保護作用、抗炎症作用の関与も推察される。さらに、移植後、機能改善がみられた後にプロドラックを投与すると、未分化な状態で残存した治療用NSCを選択的に死滅させ、腫瘍化リスクを回避することに成功した。以上より、同研究で脳挫傷に対し、自殺遺伝子を導入した治療用NSCの有効性および安全性を証明することに成功した。
「遺伝子細胞療法」の基盤技術となる可能性
同法は、幹細胞治療と遺伝子治療を組み合わせた新規の治療法であり、今後の遺伝子細胞療法の基盤技術になると考えられる。現在、国産技術のゲノム編集法を用いてiPS細胞に「yCD-UPRT遺伝子」を組み込み、臨床グレードの治療用NSCの作製準備を行っているという。
「脳挫傷の機能予後改善を目指した再生医療の実現のため、早期に臨床治験を開始ができるよう、一層尽力していく」と、研究グループは述べている。
▼関連リンク
・慶應義塾大学 プレスリリース




