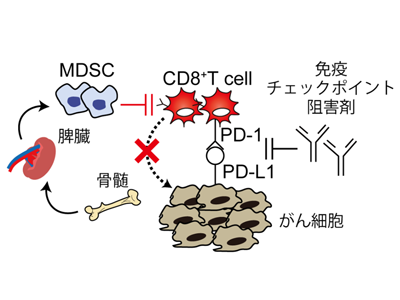
MDSCの腫瘍への浸潤、がん免疫療法の奏効率を下げる一因と考えられている
東北大学は1月30日、治療標的として脾臓内の炎症環境に着目し、慢性炎症の改善を介してMDSCの組織間クロストークを断ち切り、二次的に抗腫瘍免疫を正常化する戦略を考案したと発表した。この研究は、同大大学院薬学研究科の秋田英万教授、千葉大学大学院薬学研究院の田中浩揮助教、医学薬学府博士後期課程3年生の土井瑞貴氏、医学薬学府博士後期課程(当時)の大東昂良博士らの研究グループによるもの。研究成果は、「Small」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
近年、がんが形成する免疫抑制性の微小環境を改善することで、宿主本来の抗腫瘍免疫が活性化され、がん治療へとつながる「がん免疫療法」が新たな治療方法として着目を受けている。特に抗PD-1/PD-L1抗体を始めとする免疫チェックポイント阻害剤が次世代のがん治療薬として着目され、これらの上市をきっかけにがん免疫療法が急激に発展した。しかしながら、免疫チェックポイント阻害剤による治療効果は約30%の患者しか有効性が認められておらず、その奏効率が問題視されている。奏効率が低い原因の一つとして骨髄由来抑制細胞(MDSC)の腫瘍組織内への浸潤が考えられている。
MDSCは、PD-1/PD-L1以外の経路によって腫瘍組織内の免疫抑制環境を形成させ、抗腫瘍免疫を抑えることで免疫チェックポイント阻害剤の治療抵抗性やがん疾患の増悪に寄与している。MDSCは骨髄で産生された後、二次リンパ組織であり免疫細胞のリザーバーである脾臓から血液を介して腫瘍組織へと供給される。腫瘍存在下においては生体で慢性的な炎症環境が形成されることにより、MDSCの分化、遊走が促進され、脾臓に貯蓄される。このMDSCの組織間のクロストークによって、MDSCが腫瘍組織内に浸潤し、抗腫瘍免疫が抑制されると考えられている。
抗炎症薬を脂質からなるナノ粒子に搭載しマウスモデルに投与、単独で抗腫瘍効果を発揮
研究グループは、治療標的として脾臓内の炎症環境に着目し、慢性炎症の改善を介してMDSCの組織間クロストークを断ち切り、二次的に抗腫瘍免疫を正常化する戦略、「RISET(Reprograming of Immuno-reaction in Spleen andExtra-prarenchyma in Tumor)療法」を考案した。まず、脾臓に存在する貪食細胞に効率的に抗炎症薬(デキサメタゾン)を送達するため、この薬物を脂質からなるナノ粒子に搭載した。抗腫瘍免疫においてがん細胞の排除を担うT細胞はナノ粒子を認識する能力が極めて乏しいため、抗腫瘍免疫を妨げずに慢性炎症だけを改善できると仮説を立てた。がんを移植したマウスモデルに対してこの粒子を投与したところ、脾臓と腫瘍組織において炎症性サイトカインやケモカインの産生が抑制された。また、この粒子は単独で抗腫瘍効果を発揮した。粒子化されていないデキサメタゾンでは抗腫瘍効果が減弱したことから、ナノ粒子化が重要であることが示唆された。
脾臓、血液、腫瘍組織の順にMDSCが減少
この粒子の抗腫瘍効果のメカニズムを解明するため、研究グループは各組織におけるMDSCの量を評価した。その結果、抗炎症薬搭載型ナノ粒子を投与することによって、早いタイムポイントにおいては脾臓でのみMDSCが減少し、時間を経るにしたがって、血液、腫瘍組織の順に減少していくことが見出された。一方、MDSCの産生部位である骨髄内ではMDSCが増加する結果が示され、移動できなかった細胞が骨髄に隔離されている可能性が示唆された。また、腫瘍組織内に浸潤する疲弊T細胞の減少も観察され抗腫瘍免疫の活性化が示唆された。
抗PD-1抗体との併用によってさらに高い治療効果を確認
さらに、MDSCの誘導能が異なるがん種を複数用いてこの粒子の治療効果を検証したところ、MDSCの誘導能が高い場合にのみ、有意な腫瘍体積の減少が認められた。これらの結果から、脾臓を標的として体内の慢性炎症を改善することで組織間のMDSCのクロストークを阻害できることが明らかになった。また、腫瘍組織へのMDSCの浸潤が抑えられたことで抑制性の免疫環境が改善され、抗腫瘍免疫の活性化を介して抗がん効果が得られることを実証した。
最後に研究グループはRISET療法により腫瘍内のMDSCが減少することで、免疫チェックポイント阻害剤の効果を増強できると考えた。その結果、抗PD-1抗体あるいはナノ粒子の単剤群と比較して、両者の併用群により高い治療効果が認められ、抗炎症薬搭載ナノ粒子によって免疫チェックポイント阻害剤の治療効果を増強できることを見出した。
細胞傷害性を持たない「抗炎症薬」を利用し、治療効果を実現できる点で有用性が高い
従来のがん治療における薬物送達戦略は殺細胞効果を持った「抗がん剤」を「がん細胞」へと送達し、効率よくがん細胞を排除する戦略が多く研究されている。一方で、今回の戦略は細胞傷害性を持たない「抗炎症薬」を利用して治療効果を実現できる点で既存の研究とは一線を画しており、化学療法の観点からも有用性が高いと考えられる。また、MDSCの誘導能が高いがん種で治療効果が発揮できることが判明しているため、血中のMDSC量などが治療効果を予想する指標(バイオマーカー)になり得ると考えられ、個別化医療へと応用を広げることが可能である。「さらに、近年問題視されている免疫チェックポイント阻害剤の奏効率を克服する可能性も見出していることから、がん患者に対して新たな選択肢を提示できると期待される」と、研究グループは述べている。
▼関連リンク
・東北大学 プレスリリース



